题目内容
将0.1mol/L稀氨水加水稀释,下列说法正确的是( )
| A、溶液中c(H+)和c(OH-)都减小 |
| B、溶液中c(H+)增大 |
| C、NH3?H2O电离平衡向左移动 |
| D、溶液pH增大 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:醋酸是弱电解质,加水稀释促进醋酸电离,但溶液中氢离子浓度减小,温度不变,水的电离平衡常数不变,据此分析解答.
解答:
解:A.加水稀释,促进氨水电离,但氢氧根离子增大的个数远远小于水增加的体积,所以氢氧根离子浓度降低,温度不变,水的离子积常数不变,则氢离子浓度增大,故A错误;
B.加水稀释,促进氨水电离,氢氧根离子增大的个数远远小于水增加的体积,所以氢氧根离子浓度减小,温度不变,水的离子积常数不变,则氢离子浓度增大,故B正确;
C.加水稀释促进氨水电离,所以平衡向右移动,故C错误;
D.加水稀释,氢氧根离子浓度降低,pH减小,故D错误;
故选:B.
B.加水稀释,促进氨水电离,氢氧根离子增大的个数远远小于水增加的体积,所以氢氧根离子浓度减小,温度不变,水的离子积常数不变,则氢离子浓度增大,故B正确;
C.加水稀释促进氨水电离,所以平衡向右移动,故C错误;
D.加水稀释,氢氧根离子浓度降低,pH减小,故D错误;
故选:B.
点评:本题考查了弱电解质的电离,明确弱电解质的电离特点及水的离子积常数只与温度有关即可解答,易错选项是D,很多同学认为“加水稀释促进醋酸电离,氢离子个数增大,所以其浓度增大”,忽略了溶液体积的变化而导致错误,为易错点.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
下列关于“物质的量”、“摩尔”和“摩尔质量”的叙述中正确的是( )
| A、物质的摩尔质量等于其相对分子(原子)质量 |
| B、物质的量是一个基本的物理量,单位是摩尔 |
| C、0.12kg12C中所含的碳原子数为阿佛加德常数 |
| D、1mol任何物质中都含有阿佛加德常数个原子 |
配制2mol/L的NaOH的溶液90mL,应选用的容量瓶型号及称取的NaOH固体的质量分别为( )
| A、100mL容量瓶,7.2g |
| B、100mL容量瓶,8g |
| C、500mL容量瓶,8g |
| D、500mL容量瓶,7.2g |
 已知
已知  可简写为
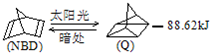
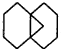
可简写为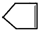 利用某些有机物之间的转化可贮存太阳能,如原降冰片二烯(NBD)经太阳光照转化成四环烷(Q)的反应为如图所示下列有关说法不正确的是( )
利用某些有机物之间的转化可贮存太阳能,如原降冰片二烯(NBD)经太阳光照转化成四环烷(Q)的反应为如图所示下列有关说法不正确的是( )| A、物质Q比NBD更稳定 |
| B、物质Q的一氯取代物只有3种 |
| C、一定条件下,1 mol NBD最多可与2 mol Br2发生加成反应 |
| D、NBD和Q二者互为同分异构体 |
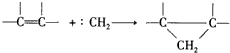
 .
.