题目内容
常温下,某同学从一种强酸性的未知无色溶液中检验出Ag+,他还想通过实验检验溶液中是否含有大量的Cl-、CO32-、Cu2+、Fe3+、K+等.其中, 是需要检验的,检验方法是 ;而 是不需要检验的.
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:溶液无色,则由颜色的离子不能大量存在,溶液中含有Ag+,则与Ag+反应的离子不能大量共存,以此解答该题.
解答:
解:溶液无色,则有颜色的Cu2+、Fe3+不能存在,溶液中含有Ag+,则与Ag+反应的Cl-、CO32-不能大量共存,题中没有涉及K+,且能与Ag+共存,需要进行检验,可通过焰色反应进行,通过蓝色钴玻璃观察焰色反应为紫色;
故答案为:K+; 焰色反应; Cl-、CO32-、Cu2+、Fe3+.
故答案为:K+; 焰色反应; Cl-、CO32-、Cu2+、Fe3+.
点评:本题考查离子的性质,侧重于学生的分析能力的考查,为高频考点,注意把握题目无色并含有银离子的要求,把握常见离子的性质以及反应类型的判断,难度不大.

练习册系列答案
相关题目
下列物质性质的变化规律,与共价键键能大小有关的是( )
| A、F2、Cl2、Br2、I2的熔点、沸点逐渐升高 |
| B、HF、HCl、HBr、HI的热稳定性依次减弱 |
| C、H2O熔沸点高于H2S.HF熔沸点高于HCl |
| D、NaF、NaCl、NaBr、Nal的熔点依次降低 |
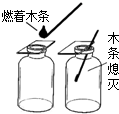 观察如图中的有关操作和现象,判断下列叙述正确的是( )
观察如图中的有关操作和现象,判断下列叙述正确的是( )| A、集气瓶中的气体可能是CO2 |
| B、集气瓶中的气体可能是空气 |
| C、集气瓶中的气体一定是O2 |
| D、集气瓶中的气体一定是N2 |
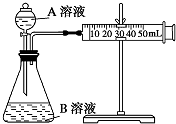 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.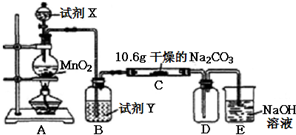



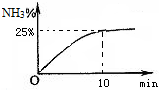 含氮化合物对人类生活有十分重大的意义.
含氮化合物对人类生活有十分重大的意义.