题目内容
 含氮化合物对人类生活有十分重大的意义.
含氮化合物对人类生活有十分重大的意义.(1)目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合.
已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
①写出工业合成氨的热化学方程式:
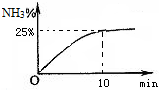
②实验室模拟合成氨,在2L密闭容器中投入1molN2和3molH2,容器中氨气的体积分数随时间变化如图所示.则0~10min,NH3的平均速率为
③若在②达平衡后,保持容器体积及温度不变,移走0.5molNH3,再达平衡时,N2的体积分数将,平衡常数
(2)科学家一直致力于研究常温常压下“人工固氮”的方法.据报道:在常温常压条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水反应,生成NH3和一种单质.进一步研究NH3生成量与温度关系,部分实验数据如下(反应时间3h,其余条件一样)
| T/℃ | 30 | 40 | 50 |
| NH3生成量/10-6mol | 4.8 | 5.9 | 6.0 |
②该反应中的催化剂TiO2的制取方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解.写出TiCl4水解的化学方程式:
③在上述固氮过程中,除加入催化剂外,能提高生产速率,但不降低产率的措施还可以是
A.适当升高温度
B.将氨气液化分离
C.增大反应物N2的浓度
D.增大压强.
考点:热化学方程式,化学平衡的影响因素,化学平衡的计算
专题:基本概念与基本理论
分析:(1)①根据盖斯定律计算焓变书写热化学方程式;
②根据三行式计算反应速率和转化率,v=
,转化率=
×100%;
③根据影响化学平衡移动的因素以及影响K的因素来回答即可;
(2)①根据已知反应物和生成物分析出另一种产物,再利用氧化还原配平法配平;图表分析温度升高,平衡状态氨气的物质的量增大,说明升温平衡正向进行,正反应为吸热反应;
②根据信息:将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解可以得到二氧化钛来书写方程式;
③根据影响化学反应速率的因素和影响平衡的因素来回答.
②根据三行式计算反应速率和转化率,v=
| △c |
| △t |
| 变化量 |
| 初始量 |
③根据影响化学平衡移动的因素以及影响K的因素来回答即可;
(2)①根据已知反应物和生成物分析出另一种产物,再利用氧化还原配平法配平;图表分析温度升高,平衡状态氨气的物质的量增大,说明升温平衡正向进行,正反应为吸热反应;
②根据信息:将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解可以得到二氧化钛来书写方程式;
③根据影响化学反应速率的因素和影响平衡的因素来回答.
解答:
解:(1)已知:a、N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
b、4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905kJ/mol
c、2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
则反应N2(g)+3H2(g)?2NH3(g)可以是:a+
×b-
×c得到,所以△H=180.5kJ/mol+
×(-905kJ/mol)-
×(-483.6kJ/mol)=-92.4kJ/mol,故答案为:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol;
②在2L密闭容器中投入1molN2和3molH2,平衡时,容器中氨气的体积分数是25%,设氮气的变化量是x,则
N2+3H2?2NH3,
起始量(mol) 0.5 1.5 0
变化量(mol) x 3x 2x
平衡量(mol)0.5-x 1.5-3x 2x
容器中氨气的体积分数是25%,得到
=25%,解得x=0.2mol/L,
N2的转化率=
×100%=40%;则0~10min,NH3的平均速率为
=0.04mol/(L?min).
故答案为:0.04mol/(L?min);40%;
③若在②达平衡后,保持容器体积及温度不变,移走0.5molNH3,压强减小,平衡逆向移动,再达平衡时,N2的体积分数将增大,平衡常数只受温度的影响,温度不变,K不变,故答案为:增大;不变;
(2)①已知反应物是N2和H2O生成物有NH3,N2→NH3用氮元素化合价降低,则氧元素化合价一定升高,所以另一种产物为氧气,再根据氧化还原配平法配平方程式为:2N2+6H2O
4NH3+3O2,图表分析温度升高,平衡状态氨气的物质的量增大,说明升温平衡正向进行,正反应为吸热反应,△H>0;
故答案为:2N2+6H2O
4NH3+3O2;>;
②根据信息:将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解可以得到二氧化钛,即TiCl4+2H2O
TiO2+4HCl,故答案为:TiCl4+2H2O
TiO2+4HCl;
③A.适当升高温度,能提高其反应速率且平衡正移,故A正确;
B.将氨气液化分离,能减慢其反应速率且平衡正移,故B错误;
C.增大反应物N2的浓度,能提高其反应速率且平衡正移,故C正确;
D.增大压强,能提高其反应速率且平衡逆向移动,故D错误;
故选AC.
b、4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905kJ/mol
c、2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
则反应N2(g)+3H2(g)?2NH3(g)可以是:a+
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
②在2L密闭容器中投入1molN2和3molH2,平衡时,容器中氨气的体积分数是25%,设氮气的变化量是x,则
N2+3H2?2NH3,
起始量(mol) 0.5 1.5 0
变化量(mol) x 3x 2x
平衡量(mol)0.5-x 1.5-3x 2x
容器中氨气的体积分数是25%,得到
| 2x |
| 0.5-x+1.5-3x+2x |
N2的转化率=
| 0.2 |
| 0.5 |
| 0.4mol/L |
| 10min |
故答案为:0.04mol/(L?min);40%;
③若在②达平衡后,保持容器体积及温度不变,移走0.5molNH3,压强减小,平衡逆向移动,再达平衡时,N2的体积分数将增大,平衡常数只受温度的影响,温度不变,K不变,故答案为:增大;不变;
(2)①已知反应物是N2和H2O生成物有NH3,N2→NH3用氮元素化合价降低,则氧元素化合价一定升高,所以另一种产物为氧气,再根据氧化还原配平法配平方程式为:2N2+6H2O
| ||
故答案为:2N2+6H2O
| ||
②根据信息:将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解可以得到二氧化钛,即TiCl4+2H2O
| ||
| ||
③A.适当升高温度,能提高其反应速率且平衡正移,故A正确;
B.将氨气液化分离,能减慢其反应速率且平衡正移,故B错误;
C.增大反应物N2的浓度,能提高其反应速率且平衡正移,故C正确;
D.增大压强,能提高其反应速率且平衡逆向移动,故D错误;
故选AC.
点评:本题涉及热化学中盖斯定律的应用以及化学反应速率、平衡的计算等知识,属于综合知识的考查,难度不大.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
欲提纯含有少量Ba(NO3)2杂质的KNO3溶液,需使用的装置为( )
A、 |
B、 |
C、 |
D、 |

 有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如表: 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空: