题目内容
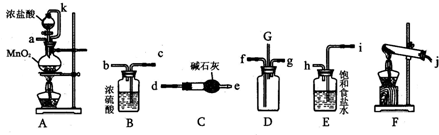
某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
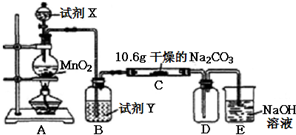
(1)写出装置A中发生反应的离子方程式:
(2)写出试剂Y的名称: .
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物.可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究.
①提出合理假设:
假设一:存在两种成分:NaHCO3和 .
假设二:存在三种成分:NaHCO3和 、 .
②设计方案,进行实验.请写出实验步骤以及预期现象和结论(可不填满).
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
(4)己知C中有0.1mol Cl2参加反应.若假设一成立,可推知C中反应的化学方程式为 .
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH-)-c(H+)= (用只含碳元素的粒子浓度表示).

(1)写出装置A中发生反应的离子方程式:
(2)写出试剂Y的名称:
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物.可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究.
①提出合理假设:
假设一:存在两种成分:NaHCO3和
假设二:存在三种成分:NaHCO3和
②设计方案,进行实验.请写出实验步骤以及预期现象和结论(可不填满).
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. |  |
| 步骤2:向A试管中滴加 | ①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠. |
| 步骤3:向B试管中滴加 | 若溶液变浑浊,结合步骤2中的①,则假设 一成立:结合步骤2中的②,则假设二成立. |
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH-)-c(H+)=
考点:性质实验方案的设计,氯气的化学性质,钠的重要化合物
专题:实验设计题
分析:(1)实验室制备氯气是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
(2)依据装置分析,进入C之前需要吸收氯化氢气体,需要用饱和食盐水吸收;
(3)①在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物).C中含氯元素的盐只有一种,且含有NaHCO3.
假设存在两种成分,为NaHCO3和NaCl;
假设存在三种成分,应还有未完全反应的Na2CO3,即是NaHCO3、NaCl和Na2CO3.
②步骤2中向A试管中滴加适量BaCl2溶液,是检验产物中是否有Na2CO3,回答该小题时要结合最后的结论,a应为证明固体中不含Na2CO3,b应为证明固体中含Na2CO3,不能颠倒.
步骤3应是检验氯离子,应向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液,若溶液变浑浊,证明固体中含有NaCl;
(4)依据氧化还原反应电子守恒计算判断氯元素化合价写出化合物化学式,依据反应物和生成物配平书写化学方程式;
(5)根据物料守恒、电荷守恒计算c(OH-)-c(H+)的值.
(2)依据装置分析,进入C之前需要吸收氯化氢气体,需要用饱和食盐水吸收;
(3)①在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物).C中含氯元素的盐只有一种,且含有NaHCO3.
假设存在两种成分,为NaHCO3和NaCl;
假设存在三种成分,应还有未完全反应的Na2CO3,即是NaHCO3、NaCl和Na2CO3.
②步骤2中向A试管中滴加适量BaCl2溶液,是检验产物中是否有Na2CO3,回答该小题时要结合最后的结论,a应为证明固体中不含Na2CO3,b应为证明固体中含Na2CO3,不能颠倒.
步骤3应是检验氯离子,应向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液,若溶液变浑浊,证明固体中含有NaCl;
(4)依据氧化还原反应电子守恒计算判断氯元素化合价写出化合物化学式,依据反应物和生成物配平书写化学方程式;
(5)根据物料守恒、电荷守恒计算c(OH-)-c(H+)的值.
解答:
解:(1)实验室制备氯气,结合装置分析可知是利用二氧化锰和浓盐酸加热反应生成氯气,反应的化学方程式为:4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O,即:4H++2Cl-+MnO2
Mn2++Cl2↑+2H2O;
故答案为:4H++2Cl-+MnO2
Mn2++Cl2↑+2H2O;
(2)实验制备氯气中含有氯化氢气体,需要用饱和食盐水除去,故答案为:饱和食盐水(或饱和氯化钠溶液);
(3)①在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物).C中含氯元素的盐只有一种,且含有NaHCO3.
假设存在两种成分,为NaHCO3和NaCl;
假设存在三种成分,应还有未完全反应的Na2CO3,即是NaHCO3、NaCl和Na2CO3.
故答案为:NaCl;NaCl、Na2CO3;
②步骤2中向A试管中滴加适量BaCl2溶液,是检验产物中是否有Na2CO3,回答该小题时要结合最后的结论,a应为证明固体中不含Na2CO3,b应为证明固体中含Na2CO3,不能颠倒.
步骤3应是检验氯离子,应向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液,若溶液变浑浊,证明固体中含有NaCl,即
故答案为:
(4)C中有0.1mol Cl2参加反应.装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,若假设一成立,反应为Cl2+Na2CO3→NaHCO3+NaCl+X,依据氧化还原反应电子守恒计算判断氯元素化合价为+1价:可推知C中反应生成的含氯氧化物为Cl2O;反应的化学方程式为:2Cl2+H2O+2Na2CO3═2NaHCO3+2NaCl+Cl2O,
故答案为:2Cl2+H2O+2Na2CO3═2NaHCO3+2NaCl+Cl2O;
(5)根据物料守恒得,3[c(CO32-)+c(HCO3- )+c(H2CO3)]=2c(Na+ ),所以c(Na+ )=
[c(CO32-)+c(HCO3- )+c(H2CO3)],根据溶液中电荷守恒得:2c(CO32-)+c(HCO3- )+c(OH-)=c(Na+ )+c(H+ ),所以c(OH-)-c(H+)=c(Na+ )-c(HCO3- )-2c(H2CO3)=
[c(CO32-)+c(HCO3- )+c(H2CO3)]-c(HCO3- )-2c(H2CO3)=
c(H2CO3)+
c(HCO3- )-
c(CO32- ).
故答案为:
c(H2CO3)+
c(HCO3- )-
c(CO32- ).
| ||
| ||
故答案为:4H++2Cl-+MnO2
| ||
(2)实验制备氯气中含有氯化氢气体,需要用饱和食盐水除去,故答案为:饱和食盐水(或饱和氯化钠溶液);
(3)①在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物).C中含氯元素的盐只有一种,且含有NaHCO3.
假设存在两种成分,为NaHCO3和NaCl;
假设存在三种成分,应还有未完全反应的Na2CO3,即是NaHCO3、NaCl和Na2CO3.
故答案为:NaCl;NaCl、Na2CO3;
②步骤2中向A试管中滴加适量BaCl2溶液,是检验产物中是否有Na2CO3,回答该小题时要结合最后的结论,a应为证明固体中不含Na2CO3,b应为证明固体中含Na2CO3,不能颠倒.
步骤3应是检验氯离子,应向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液,若溶液变浑浊,证明固体中含有NaCl,即
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | 无明显现象 |
| 步骤2:向A试管中滴加BaCl2溶液 | a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,证明固体中含有NaCl |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | 无明显现象 |
| 步骤2:向A试管中滴加BaCl2溶液 | a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,证明固体中含有NaCl |
故答案为:2Cl2+H2O+2Na2CO3═2NaHCO3+2NaCl+Cl2O;
(5)根据物料守恒得,3[c(CO32-)+c(HCO3- )+c(H2CO3)]=2c(Na+ ),所以c(Na+ )=
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:
| 3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
点评:本题考查了物质性质验证的实验设计,步骤分析判断,现象分析理解,掌握物质性质和实验设计方法是解题关键,题目难度较大.

练习册系列答案
相关题目
下列离子方程式与所述事实相符且正确的是( )
| A、磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-═3Fe3++NO↑+4H2O |
| B、用食醋除去暖水瓶中的水垢:2H++CaCO3═Ca2++CO2↑+H2O |
| C、少量SO2滴入NaClO溶液中:SO2+2ClO-+H2O═SO32+2HClO |
| D、向水玻璃中通入足量CO2:SiO32-+2CO2+2H20═H2SiO3↓+2HCO3- |