题目内容
某学生为测定未知浓度的醋酸溶液,实验如下:用10.00mL待测醋酸配制100mL稀醋酸溶液;以0.14mol?L-1的NaOH溶液滴定上述稀醋酸25mL,滴定终止时消耗NaOH溶液15.00mL.
(1)该学生用标准0.14 mol?L-1NaOH溶液滴定醋酸的实验操作如下:
A.用a滴定管取稀醋酸25mL,注入锥形瓶中,加入指示剂.
B.用待测定的溶液润洗a滴定管.
C.用蒸馏水洗干净滴定管.
D.取下b滴定管用标准的NaOH溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下.
E.检查滴定管是否漏水.
F.另取锥形瓶,再重复操作一次.
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度.
回答下列问题
①a、b滴定管名称分别是 、 ;
②滴定操作的正确顺序是(用序号填写): → → →( A )→ → →
(2)对两种假定情况的讨论:(填“无影响”、“偏高”、“偏低”)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果: ;
②碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果 ,
(3)若利用pH计测定反应后混合溶液pH来判断滴定终点,当混合液pH=7时,下列说法正确的是 (填写字母).
A.醋酸与NaOH溶液恰好完全反应 B.醋酸稍过量 C.NaOH溶液稍过量.
(1)该学生用标准0.14 mol?L-1NaOH溶液滴定醋酸的实验操作如下:
A.用a滴定管取稀醋酸25mL,注入锥形瓶中,加入指示剂.
B.用待测定的溶液润洗a滴定管.
C.用蒸馏水洗干净滴定管.
D.取下b滴定管用标准的NaOH溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下.
E.检查滴定管是否漏水.
F.另取锥形瓶,再重复操作一次.
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度.
回答下列问题
①a、b滴定管名称分别是
②滴定操作的正确顺序是(用序号填写):
(2)对两种假定情况的讨论:(填“无影响”、“偏高”、“偏低”)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果:
②碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果
(3)若利用pH计测定反应后混合溶液pH来判断滴定终点,当混合液pH=7时,下列说法正确的是
A.醋酸与NaOH溶液恰好完全反应 B.醋酸稍过量 C.NaOH溶液稍过量.
考点:中和滴定
专题:实验题
分析:(1)①根据酸性溶液盛放在酸式滴定管中,碱性溶液盛放在碱式滴定管中;
②根据中和滴定有检漏、洗涤、润洗、装液、调零、取待测液并加指示剂、滴定等操作;
(2)根据c(待测)=
分析不当操作对V(标准)的影响,以此判断浓度的误差.
(3)根据醋酸和氢氧化钠恰好反应生成醋酸钠,溶液呈碱性,若呈中性,醋酸应稍过量.
②根据中和滴定有检漏、洗涤、润洗、装液、调零、取待测液并加指示剂、滴定等操作;
(2)根据c(待测)=
| V(标)×c(标) |
| V(待测) |
(3)根据醋酸和氢氧化钠恰好反应生成醋酸钠,溶液呈碱性,若呈中性,醋酸应稍过量.
解答:
解:(1)①用酸式滴定管取稀醋酸25mL;取下碱式滴定管用标准的NaOH溶液润洗后,
故答案为:酸式滴定管;碱式滴定管;
②中和滴定有检漏、洗涤、润洗、装液、调零、取待测液并加指示剂、滴定等操作,所以滴定操作的正确顺序是E→C→B→A→D→G→F,
故答案为:E;C;B;D;G;F;
(2)①若用蒸馏水冲洗锥形瓶,待测液的物质的量不变,对V(标)无影响,根据c(待测)=
分析,可知c(待测)无影响;
②碱式滴定管用蒸馏水润洗后,未用标准液润洗,标准液浓度偏小,造成V(标)偏大,根据c(待测)=
分析,可知c(待测)偏高;
故答案为:无影响;偏高;
(3)根据醋酸和氢氧化钠恰好反应生成醋酸钠,溶液呈碱性,若呈中性,醋酸应稍过量,故选B.
故答案为:酸式滴定管;碱式滴定管;
②中和滴定有检漏、洗涤、润洗、装液、调零、取待测液并加指示剂、滴定等操作,所以滴定操作的正确顺序是E→C→B→A→D→G→F,
故答案为:E;C;B;D;G;F;
(2)①若用蒸馏水冲洗锥形瓶,待测液的物质的量不变,对V(标)无影响,根据c(待测)=
| V(标)×c(标) |
| V(待测) |
②碱式滴定管用蒸馏水润洗后,未用标准液润洗,标准液浓度偏小,造成V(标)偏大,根据c(待测)=
| V(标)×c(标) |
| V(待测) |
故答案为:无影响;偏高;
(3)根据醋酸和氢氧化钠恰好反应生成醋酸钠,溶液呈碱性,若呈中性,醋酸应稍过量,故选B.
点评:本题主要考查了酸碱中和滴定的操作、误差分析,难度中等,掌握中和滴定的原理、步骤是解题的关键.

练习册系列答案
相关题目
下列废弃物,不可直接回收利用的是( )
| A、易拉罐 |
| B、干电池 |
| C、玻璃白酒瓶 |
| D、聚乙烯、聚丙烯废弃物 |
下列物质中所含原子数最多的是( )
| A、0.3 mol SO3 |
| B、66 g CO2 |
| C、6.02×1023个NH3分子 |
| D、4℃时18 mL的水 |
下列离子方程式正确的是( )
| A、FeCl3溶液中加入过量的氨水:Fe3++3OH-→Fe(OH)3↓ |
| B、AlCl3溶液中加入过量的氨水:Al3++3NH3?H2O=Al (OH)3↓+3NH4+ |
| C、铁与稀盐酸反应:2Fe+6H+→2Fe3++3H2↑ |
| D、氯化亚铁溶液中通入少量氯气:Fe2++Cl2→Fe3++2Cl- |
用已知浓度的酸滴定未知浓度的碱时,会导致待测碱液的浓度偏低的操作是( )
①酸式滴定管用蒸馏水洗后,未用标准液润洗
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③配制碱液时,称量的固体吸潮
④滴定前酸式滴定管尖嘴部分未充满溶液
⑤滴定中不慎将锥形瓶内液体摇出少量于瓶外.
①酸式滴定管用蒸馏水洗后,未用标准液润洗
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③配制碱液时,称量的固体吸潮
④滴定前酸式滴定管尖嘴部分未充满溶液
⑤滴定中不慎将锥形瓶内液体摇出少量于瓶外.
| A、①③④ | B、②⑤ |
| C、②③⑤ | D、①③ |
下列叙述错误的是( )
| A、福尔马林、葡萄糖与银氨溶液共热都有光亮的银镜生成 |
B、有机物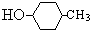 的消去产物有两种 的消去产物有两种 |
| C、鸡蛋清溶液中加入饱和(NH4)2SO4溶液后产生沉淀,是因为蛋白质发生了盐析 |
| D、沾附在试管内壁上的油脂,用热碱液洗涤 |
 是一种医药中间体,常用来制备抗凝血药,可通过下列流程合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列流程合成: