题目内容
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K= .
(2)该反应为 反应(选填吸热、放热).
(3)下列条件可改变这个反应的化学平衡状态的是 .
a.增大压强 b.降低温度 c.加入适当的催化剂 d.吸收水蒸气
(4)某温度下,平衡浓度符合下式:9×c(CO2)?c(H2)=10×c(CO)?c(H2O)试判断此时的温度为 ℃.
CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)下列条件可改变这个反应的化学平衡状态的是
a.增大压强 b.降低温度 c.加入适当的催化剂 d.吸收水蒸气
(4)某温度下,平衡浓度符合下式:9×c(CO2)?c(H2)=10×c(CO)?c(H2O)试判断此时的温度为
考点:化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)化学平衡常数表达式为生成物浓度幂之积比上反应物浓度幂之积;
(2)由表中数据可知,温度越高平衡常数越大,说明升高温度平衡向正反应移动,温度升高平衡向吸热反应移动;
(2)根据化学反应的特征和外界条件对化学反应速率的影响综合判断,以此解答;
(4)根据c(CO2)?c(H2)=c(CO)?c(H2O)可知,该温度下的平衡常数为1,据此判断.
(2)由表中数据可知,温度越高平衡常数越大,说明升高温度平衡向正反应移动,温度升高平衡向吸热反应移动;
(2)根据化学反应的特征和外界条件对化学反应速率的影响综合判断,以此解答;
(4)根据c(CO2)?c(H2)=c(CO)?c(H2O)可知,该温度下的平衡常数为1,据此判断.
解答:
解:(1)化学平衡常数表达式为生成物浓度幂之积比上反应物浓度幂之积,所以K=
,故答案为:
;
(2)由表中数据可知,温度越高平衡常数越大,说明升高温度平衡向正反应移动,温度升高平衡向吸热反应移动,故该反应正反应是吸热反应,
故答案为:吸热;
(3)a.两边的计量数相等,增大压强平衡不移动,故错误;
b.降低温度,平衡逆向移动,故正确;
c.加入适当的催化剂,平衡不移动,故错误;
d.吸收水蒸气,平衡正向移动,故正确;
故选:bd;
(4)根据9×c(CO2)?c(H2)=10×c(CO)?c(H2O)可知,该温度下的平衡常数
=0.9,平衡常数只与温度有关,故此时温度为800℃;故答案为:800.
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
(2)由表中数据可知,温度越高平衡常数越大,说明升高温度平衡向正反应移动,温度升高平衡向吸热反应移动,故该反应正反应是吸热反应,
故答案为:吸热;
(3)a.两边的计量数相等,增大压强平衡不移动,故错误;
b.降低温度,平衡逆向移动,故正确;
c.加入适当的催化剂,平衡不移动,故错误;
d.吸收水蒸气,平衡正向移动,故正确;
故选:bd;
(4)根据9×c(CO2)?c(H2)=10×c(CO)?c(H2O)可知,该温度下的平衡常数
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
点评:本题考查化学平衡常数的应用、化学平衡移动,难度中等,掌握化学平衡常数的书写与应用,比较容易.

练习册系列答案
相关题目
下列反应中,属于氧化还原反应的是( )
| A、CaCO3+2HCl=CaCl2+H2O+CO2↑ |
| B、HCl+NaOH=NaCl+H2O |
| C、Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓ |
| D、CuCl2+Fe=FeCl2+Cu |
下列溶液中含Cl-浓度最大的是( )
| A、10m1,0.1mol?L-1的AlC13溶液 |
| B、20m1,0.1mo1?L-1的CaC12溶液 |
| C、30m1,0.2mo1?L-1的KC1溶液 |
| D、100m1,0.25mo1?L-1的NaC1溶液 |
下列有机物的结构简式书写正确的是( )
A、TNT  |
B、硬脂酸甘油酯 |
| C、乙酸甲酯 CH3OOCCH3 |
| D、3-甲基丁醛 (CH3)2CHCH2COH |
图Ⅰ是NO2(g)+CO(g)?CO2(g)+NO(g)反应过程中能量变化示意图.一定条件下,在固定容积的密闭容器中该反应达到平衡状态.当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ,下列有关说法正确的是( )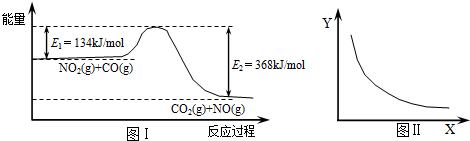

| A、该反应的焓变△H=+234 kJ?mol-1 |
| B、若X表示体系的压强,则Y表示的可能是NO2的转化率 |
| C、若X表示温度则Y表示的可能是CO2物质的量浓度 |
| D、增大CO的起始浓度,平衡向正反应方向移动,反应热增大 |


