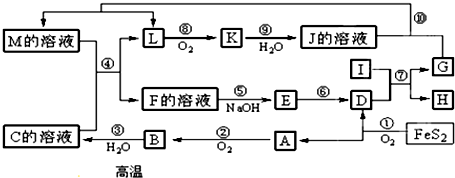
题目内容
20. (1)用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一.Fe还原水体中NO3-的反应原理如图所示.
(1)用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一.Fe还原水体中NO3-的反应原理如图所示.①作负极的物质是铁.
②正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
已知反应①中相关的化学键键能数据如表:
| 化学键 | H-H | C-O | C-O | H-O | C-H |
| E/(KJ•mol-1) | 436 | 343 | 1075 | 465 | 413 |
分析 (1)①Fe还原水体中NO3-,根据题意Fe3O4为电解质,则Fe作还原剂,失去电子,作负极;
②NO3-在正极得电子发生还原反应产生NH4+;
(2)反应热=反应物总键能-生成物总键能;根据盖斯定律:反应②-反应①=反应③,反应热也进行相应的计算.
解答 解:(1)①Fe还原水体中NO3-,则Fe作还原剂,失去电子,作负极,
故答案为:铁;
②NO3-在正极得电子发生还原反应产生NH4+,则正极的电极反应式为:NO3-+8e-+10H+=NH4++3H2O,
故答案为:NO3-+8e-+10H+=NH4++3H2O;
(2)反应热=反应物总键能-生成物总键能,故△H1=1076kJ•mol-1+2×436kJ•mol-1-(3×413+343+465)kJ•mol-1=-99kJ•mol-1,
根据盖斯定律:反应②-反应①=反应③,故△H3=△H2-△H1=-58kJ•mol-1-(-99kJ•mol-1)=+41kJ•mol-1,
故答案为:-99;+41.
点评 本题考查化学反应与能量,电化学以及反应热的计算,电极反应式的书写是易错点,注意图中信息的把握,难度中等.

练习册系列答案
相关题目
11.硫酸厂有一辆已存放过浓硫酸的铁槽车.某新工人违反规程,边吸烟边用水冲洗,结果发生了爆炸事故.下列引起爆炸的原因中正确的是( )
| A. | 浓硫酸遇明火爆炸 | |
| B. | 浓硫酸遇水发热爆炸 | |
| C. | 铁与水反应产生的氢气接触空气遇明火爆炸 | |
| D. | 稀释后的硫酸与铁反应产生的氢气接触空气遇明火爆炸 |
8.在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,完全反应后,离子数几乎没有变化的是( )
| A. | Fe3+、Al3+ | B. | Al3+ | C. | Fe2+、Al3+ | D. | NH4+ |
15.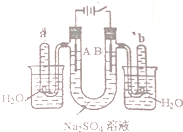 如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液.下列有关叙述正确的是( )
如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液.下列有关叙述正确的是( )
 如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液.下列有关叙述正确的是( )
如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液.下列有关叙述正确的是( )| A. | 逸出气体的体积,A电极的小于B电极的 | |
| B. | 一电极逸出无味气体,另一电极逸出刺激性气味气体 | |
| C. | A电极附近呈红色,B电极附近呈蓝色 | |
| D. | 电解一段时间后,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈中性 |
5.某溶液加入金属铝能放出氢气.下列各组离子在该溶液中一定可以大量共存的是( )
| A. | Al3+、NH4+、Cl-、SO42- | B. | Na+、Cl-、SO42-、HCO3- | ||
| C. | Na+、CH3COO-、NO3-、K+ | D. | K+、Na+、Cl-、SO42- |
12.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 气象环境报告中的“PM2.5”是对一种新分子的描述 | |
| B. | 长期使用硫酸铵(NH4)2SO4化肥会使土壤酸化 | |
| C. | “玉兔号”月球车太阳能电池帆板的材料是二氧化硅 | |
| D. | 高铁车厢采用的铝合金材料强度大、质量轻,不与氧气反应 |
9.下列电离方程式正确的是( )
| A. | NaHS 溶于水:NaHS═Na++HS- HS-?H++S2- | |
| B. | (NH4)2SO4溶于水:(NH4)2SO4?2NH4++SO42- | |
| C. | 磷酸溶于水中:H3PO4═3H++PO43- | |
| D. | Al(OH)3的电离:Al(OH)3=Al3++3OH- |