题目内容
9.已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,可知TiCl4为分子晶体.分析 分子晶体熔沸点较低,TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,可知TiCl4为晶体熔、沸点较低,即分子间作用力低,属于分子晶体.
解答 解:TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,熔沸点较低,符合分子晶体熔沸点较低的特点,所以TiCl4应为分子晶体,是共价型化合物,
故答案为:分子.
点评 本题考查晶体类型的判别,掌握分子晶体熔沸点较低的特点是解答的关键,题目较简单.

练习册系列答案
相关题目
14.电泳时,硫化砷胶粒移向正极.要使一定量硫化砷溶液聚沉下列盐中需用的物质的量最小的是( )
| A. | NaCl | B. | CaCl2 | C. | AlCl3 | D. | MgSO4 |
17.在一个氧化还原反应体系中反应物、生成物共六种粒子,Fe3+、NO3-、Fe2+、NH4+、H+和H2O,下列叙述正确的是( )
| A. | 为防止Fe2+水解,Fe(NO3)2溶液需要加酸酸化 | |
| B. | 该反应中氧化剂与还原剂物质的量之比为8:1 | |
| C. | 若有1molNO3-发生氧化反应,则转移电子5mol | |
| D. | 该反应中Fe2+是还原剂,NH4+是还原产物 |
4.下列物质的系统命名中,错误的是( )
| A. | 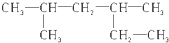 2,4-二甲基己烷 2,4-二甲基己烷 | |
| B. | 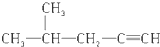 2-甲基-4-戊炔 2-甲基-4-戊炔 | |
| C. | 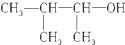 3-甲基-2-丁醇 3-甲基-2-丁醇 | |
| D. | CH3-CHBr-CHBr-CH3 2,3-二溴丁烷 |
14.在反应:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,7.5mol CuSO4可氧化磷原子的物质的量为( )
| A. | 1.5 mol | B. | 3 mol | C. | 5 mol | D. | 6 mol |
18.25°C时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol/L的溶液中:K+、Na+、NO3-、CH3COO- | |
| C. | 0.1mol•L-1NH4HCO3溶液:Na+、Fe3+、NO3-、Cl- | |
| D. | 0.1mol•L-1FeCl3溶液:Fe2+、NH4+、SCN-、SO42- |
19.下列叙述正确的是( )
| A. | 氧化物、氢化物都是只含二种元素 | |
| B. | 混合物中的元素一定是化合态的形式存在 | |
| C. | 金属氧化物一定是碱性氧化物 | |
| D. | 由一种元素组成的物质一定是纯净物 |
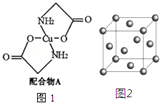 已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A.其结构如图1所示
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A.其结构如图1所示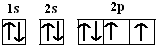 .
.