题目内容
7.下列离子方程式书写正确的是( )| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | 将过量的SO2通入Ca(ClO)2溶液中:SO2+ClO-+H2O═HClO+HSO3- | |
| C. | 向MgSO4溶液中滴加Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
分析 A.发生氧化还原反应生成硝酸铁、NO和水;
B.发生氧化原因反应生成硫酸钙;
C.漏写生成氢氧化镁的离子反应;
D.反应生成硫酸钡、水、一水合氨.
解答 解:A.Fe3O4溶于足量稀HNO3的离子反应为3Fe3O4+NO3-+28H+═9Fe3++NO↑+14H2O,故A错误;
B.将过量的SO2通入Ca(ClO)2溶液中的离子反应为Ca2++2ClO-+2H2O+2SO2=CaSO4↓+4H++2Cl-+SO42-,故B错误;
C.向MgSO4溶液中滴加Ba(OH)2溶液的离子反应为Mg2++2OH-+Ba2++SO42-═BaSO4↓+Mg(OH)2↓,故C错误;
D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全的离子反应为Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9. 液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如右图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.下列关于该电池的叙述正确的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如右图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.下列关于该电池的叙述正确的是( )
 液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如右图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.下列关于该电池的叙述正确的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如右图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.下列关于该电池的叙述正确的是( )| A. | b极发生氧化反应 | |
| B. | a极为该电池的正极 | |
| C. | 放电时,电流从a极经过负载流向b极 | |
| D. | a极的反应式:N2H4+4OH--4e-═N2↑+4H2O |
15.对于反应2SO2(g)+O2(g)?2SO3(g),下列措施能增大反应速率的是( )
①恒容条件下,再通入一定量的O2
②增大体系容积
③恒容条件下,再通入一定量的N2
④使用合适的催化剂.
①恒容条件下,再通入一定量的O2
②增大体系容积
③恒容条件下,再通入一定量的N2
④使用合适的催化剂.
| A. | ①④ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |
2.用一种试剂就能将NH4NO3、Na2SO4、(NH4)2SO4、NaCl四瓶溶液鉴别开来,此试剂是( )
| A. | BaCl2 | B. | Ba(OH)2 | C. | AgNO3 | D. | NaOH |
12.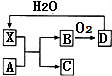 已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
 已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )| A. | X使蔗糖变黑的现象主要体现了X的强氧化性 | |
| B. | 若A为铁,则A与X在室温下不会反应 | |
| C. | 若A为碳单质,则将C通入少量的澄清石灰水中,溶液仍然澄清 | |
| D. | 工业上在高温、常压和使用催化剂的条件下,可以使B完全转化为D |
19.用下列方法制取氧气,反应速率最大的是( )
| A. | 冬天,5%H2O2溶液分解 | B. | 冬天,MnO2与5%H2O2溶液混合 | ||
| C. | 夏天,5%H2O2溶液分解 | D. | 夏天,MnO2与5%H2O2溶液混合 |
16.SO2和SO3各0.25mol,氧原子的个数比为( )
| A. | 2:3 | B. | 1:1 | C. | 1:2 | D. | 1:3 |