题目内容
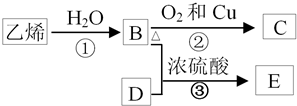
20.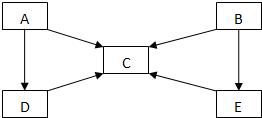 A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.
A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.(1)若:其中A、B、C、D、E在常温下都是气体,B为红棕色.
①则A的结构式是N三ND的电子式是
 .
.②写出下列反应的化学方程式:
B→C的化学方程式为3NO2+H2O=2HNO3+NO.
D→C的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
(2)若:A在常温下是淡黄色固体,且属于分子晶体.
①写出各下列物质的化学式:则C是SO2E是H2SO4.
②写出下列反应的化学方程式:
E→C的化学方程式为2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+2SO2↑+CO2↑或2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+SO2↑+CuSO4.
D和C反应的化学方程式为2H2S+SO2=2H2O+3S.
分析 (1)其中A、B、C、D、E在常温下都是气体,B为红棕色,应为NO2,结合框图转化,根据NO2的性质可知NO2反应能分别生成NO和HNO3,则C应为NO,E为HNO3,NO2可与水反应生成NO,稀HNO3可与Cu反应生成NO,含N元素物质中能生成NO的还有N2和NH3,其中N2和氢气反应还可生成NH3,则分别是:A:N2,B:NO2,C:NO,D:NH3,E:HNO3;
(2)如果A是淡黄色固体,且属于分子晶体,推断A为S,C为SO2,根据题中转化关系,A与氢气反应生成D为H2S,E为H2SO4,浓硫酸与铜加热条件下反应生成二氧化硫,符合转化关系.
解答 解:(1)其中A、B、C、D、E在常温下都是气体,B为红棕色,应为NO2,根据NO2的性质可知NO2反应能分别生成NO和HNO3,则C应为NO,E为HNO3,NO2可与水反应生成NO,稀HNO3可与Cu反应生成NO,含N元素物质中能生成NO的还有N2和NH3,其中N2和氢气反应还可生成NH3,则分别是:A:N2,B:NO2,C:NO,D:NH3,E:HNO3,
①由以上分析可知A为N2,结构式为:N三N,D为NH3,N原子的最外层有5个电子,其中3个未成对电子和1对成对电子,3个未成对电子分别和3个H原子形成3对共用电子对,故氨气的电子式为 ,
,
故答案为:N三N; ;
;
②B→C的反应是NO2可与水反应生成NO,方程式为3NO2+H2O=2HNO3+NO,D→C的反应是NH3和氧气发生催化氧化可得NO,
反应的方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:3NO2+H2O=2HNO3+NO;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)如果A是淡黄色固体,且属于分子晶体,推断A为S,C为SO2,根据题中转化关系,A与氢气反应生成D为H2S,E为H2SO4,浓硫酸与铜加热条件下反应生成二氧化硫,
①上述分析可知C为SO2,E为H2SO4,故答案为:SO2,H2SO4;
②下列反应的化学方程式,E→C的反应为浓硫酸和铜或碳加热反应生成,反应的化学方程式为:2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+2SO2↑+CO2↑ 或2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+SO2↑+CuSO4,D和C反应是硫化氢和二氧化硫生成硫单质的反应,反应的化学方程式为:2H2S+SO2=2H2O+3S,
故答案为:2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+2SO2↑+CO2↑ 或2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+SO2↑+CuSO4; 2H2S+SO2=2H2O+3S↓.
点评 本题考查了常见物质性质、物质的电子式、化学方程式书写,题目难度中等,注意转化关系和物质的特征性质理解应用,掌握基础是解题关键.

 名校课堂系列答案
名校课堂系列答案
| A. | 该反应只有在加热条件下才能进行 | |
| B. | 该反应为吸热反应 | |
| C. | 该反应为放热反应 | |
| D. | 反应物的总能量高于生成物的总能量 |
| A. | 爆炸一定都属于化学变化 | |
| B. |  盛放氰化钠的容器上应贴有如图所示的安全标识 | |
| C. | 生石灰烧伤应立即用大量的水冲洗并涂上中和剂硼酸 | |
| D. | TNT爆炸的产物只有CO、CO2及氮氧化物 |
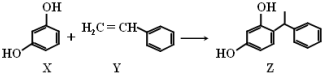
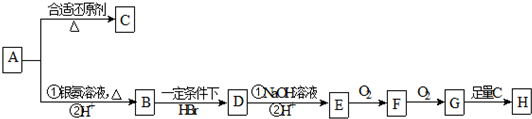
| A. | X、Y和Z均能使溴水褪色 | |
| B. | X和Z均能与Na2CO3溶液反应 | |
| C. | Y分子中所有原子可能在同一平面上 | |
| D. | Z能发生加成反应、取代反应,但不能发生氧化反应 |
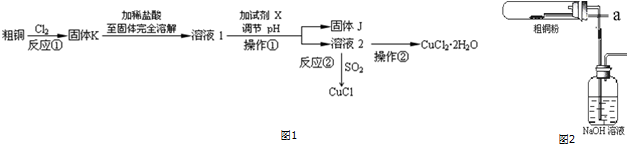
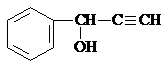 、
、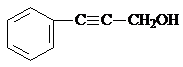 .
.