题目内容
在100ml 0.05mol/L硫酸铝溶液中加入一定质量的金属钠,共产生392ml氢气(标准状况).此时生成的氢氧化铝沉淀是多少克? .
考点:化学方程式的有关计算,钠的化学性质
专题:计算题,几种重要的金属及其化合物
分析:根据n=
计算氢气的物质的量,根据2Na+2H2O=2NaOH+H2↑计算氢氧化钠的物质的量,根据n=cV计算铝离子物质的量,再根据Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O计算.
| V |
| Vm |
解答:
解:标况下,392mL氢气的物质的量=
=0.0175mol,
由2Na+2H2O=2NaOH+H2↑,可知生成NaOH的物质的量=0.0175mol×2=0.035mol,
铝离子物质的量=0.1L×0.05mol/L×2=0.01mol,
Al3++3 OH-=Al(OH)3↓
0.01mol 0.03mol 0.01mol
剩余氢氧化钠为0.035mol-0.03mol=0.005mol,
Al(OH)3+OH-=AlO2-+2H2O
0.005mol 0.005mol
故生成沉淀的质量=(0.01mol-0.005mol)×78g/mol=0.39g,
故答案为:0.39g.
| 0.392L |
| 22.4L/mol |
由2Na+2H2O=2NaOH+H2↑,可知生成NaOH的物质的量=0.0175mol×2=0.035mol,
铝离子物质的量=0.1L×0.05mol/L×2=0.01mol,
Al3++3 OH-=Al(OH)3↓
0.01mol 0.03mol 0.01mol
剩余氢氧化钠为0.035mol-0.03mol=0.005mol,
Al(OH)3+OH-=AlO2-+2H2O
0.005mol 0.005mol
故生成沉淀的质量=(0.01mol-0.005mol)×78g/mol=0.39g,
故答案为:0.39g.
点评:本题考查化学方程式的有关计算,明确发生的反应是关键,注意氢氧根离子与铝离子反应的过量计算.

练习册系列答案
相关题目
 观察如图装置,其中a、b是两根石墨棒,有关电极反应式错误的是( )
观察如图装置,其中a、b是两根石墨棒,有关电极反应式错误的是( )| A、a电极:2Cl--2e-=Cl2↑ |
| B、b电极:2H++2e-=H2↑ |
| C、铜电极:2H++2e-=H2↑ |
| D、锌电极:4OH--4e-=2H2O+O2↑ |

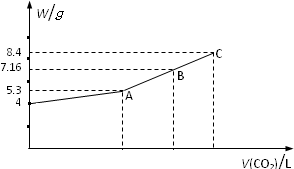 往NaOH溶液中通入CO2气体充分反应后,在低压和低温下,小心地将溶液蒸干,得到白色的固体M,通入CO2的体积V(CO2)(标准状况)与M的质量W的关系如下图.
往NaOH溶液中通入CO2气体充分反应后,在低压和低温下,小心地将溶液蒸干,得到白色的固体M,通入CO2的体积V(CO2)(标准状况)与M的质量W的关系如下图.