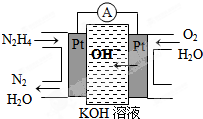
题目内容
实验室常用盐酸的质量分数为36.5%,密度为1.20g/cm3.
(1)此浓盐酸的物质的量浓度是多少?(列式计算)
(2)从该溶液中取出1L,加水稀释到10L,稀释后溶液的物质的量浓度为?
(1)此浓盐酸的物质的量浓度是多少?(列式计算)
(2)从该溶液中取出1L,加水稀释到10L,稀释后溶液的物质的量浓度为?
考点:溶液中溶质的质量分数及相关计算
专题:计算题
分析:(1)根据c=
计算质量分数为36.5%,密度为1.20g/cm3的浓盐酸的浓度;
(2)稀释前后溶质的物质的量不变,根据c(浓)×V(浓)=c(稀)×V(稀)计算稀释后溶液的物质的量浓度.
| 10000ρw |
| M |
(2)稀释前后溶质的物质的量不变,根据c(浓)×V(浓)=c(稀)×V(稀)计算稀释后溶液的物质的量浓度.
解答:
解:(1)此浓盐酸的物质的量浓度为:c=
=
mol/L=12mol/L,
答:此浓盐酸的物质的量浓度为12.0mol/L;
(2)溶液稀释前后溶质的物质的量不变,则有c(浓)×V(浓)=c(稀)×V(稀),
设稀释后溶液的物质的量浓度为c,则1L×12mol/L=c×10L,
解得:c=1.2mol/L,
答:从该溶液中取出1L,加水稀释到10L,稀释后溶液的物质的量浓度为1.2mol/L.
| 10000ρw |
| M |
| 1000×1.20×36.5% |
| 36.5 |
答:此浓盐酸的物质的量浓度为12.0mol/L;
(2)溶液稀释前后溶质的物质的量不变,则有c(浓)×V(浓)=c(稀)×V(稀),
设稀释后溶液的物质的量浓度为c,则1L×12mol/L=c×10L,
解得:c=1.2mol/L,
答:从该溶液中取出1L,加水稀释到10L,稀释后溶液的物质的量浓度为1.2mol/L.
点评:本题考查物质的量浓度的计算,题目难度不大,注意质量分数与物质的量浓度之间的换算关系,明确溶液稀释过程中溶质的物质的量不变为解答本题的关键.

练习册系列答案
相关题目
下列仪器中一般不用作反应容器的是( )
| A、试管 | B、烧瓶 | C、烧杯 | D、容量瓶 |
下列说法中错误的是( )
| A、四氯甲烷为正四面体结构 |
| B、乙烯的所有原子在同一平面 |
| C、2-丁烯不止表示一种物质 |
| D、1-丁烯存在顺反异构现象 |

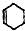 的六元环结构,六元环上只有一个取代基.
的六元环结构,六元环上只有一个取代基.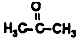 )在一定条件下发生的羟醛缩合反应,该反应除生成假性紫罗兰酮外还生成一个小分子,请写出该反应的化学方程式(不用写反应条件,
)在一定条件下发生的羟醛缩合反应,该反应除生成假性紫罗兰酮外还生成一个小分子,请写出该反应的化学方程式(不用写反应条件,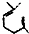 部分可用R代替).
部分可用R代替). 可用R代替).
可用R代替).