题目内容
 往NaOH溶液中通入CO2气体充分反应后,在低压和低温下,小心地将溶液蒸干,得到白色的固体M,通入CO2的体积V(CO2)(标准状况)与M的质量W的关系如下图.
往NaOH溶液中通入CO2气体充分反应后,在低压和低温下,小心地将溶液蒸干,得到白色的固体M,通入CO2的体积V(CO2)(标准状况)与M的质量W的关系如下图.(1)A点时,M的化学式为
(2)C点时,通入CO2气体的体积为
(3)B点时,M的组成成分的化学式及其物质的量各是多少?(写出详细解题过程)
考点:化学方程式的有关计算
专题:计算题
分析:由图知NaOH质量为4 g,物质的量为0.1 mol,完全转化为Na2CO3时,Na2CO3质量为0.1mol×
×106g/mol=5.3 g,完全转化为NaHCO3时,NaHCO3质量为0.1mol×84g/mol=8.4 g,故A点白色固体M为Na2CO3,C点白色固体M为NaHCO3,根据碳原子守恒可得n(CO2),根据V=nVm计算二氧化碳体积;
图B点时M的质量为7.16 g,由于5.3<7.16<8.4,知M由Na2CO3和NaHCO3组成,设在B点时Na2CO3物质的量为x,NaHCO3物质的量为y,根据钠离子守恒、二者质量之和列方程计算x、y的值.
| 1 |
| 2 |
图B点时M的质量为7.16 g,由于5.3<7.16<8.4,知M由Na2CO3和NaHCO3组成,设在B点时Na2CO3物质的量为x,NaHCO3物质的量为y,根据钠离子守恒、二者质量之和列方程计算x、y的值.
解答:
解:由图知NaOH质量为4 g,物质的量为
=0.1 mol,完全转化为Na2CO3时,Na2CO3质量为0.1mol×
×106g/mol=5.3 g,完全转化为NaHCO3时,NaHCO3质量为0.1mol×84g/mol=8.4 g,故A点白色固体M为Na2CO3,C点白色固体M为NaHCO3,
(1)由上述分析可知,A点白色固体M为Na2CO3,故答案为:Na2CO3;
(2)由上述分析可知,C点白色固体M为NaHCO3,需CO2体积为0.1 mol×22.4L?mol-1=2.24L,
故答案为:2.24L;
(3)图B点时M的质量为7.16 g,由于5.3<7.16<8.4,知M由Na2CO3和NaHCO3组成,设在B点时Na2CO3物质的量为x,NaHCO3物质的量为y,则:
解得x=0.02,y=0.06,
答:B点时,M的组成为0.02molNa2CO3、0.06molNaHCO3.
| 4g |
| 40g/mol |
| 1 |
| 2 |
(1)由上述分析可知,A点白色固体M为Na2CO3,故答案为:Na2CO3;
(2)由上述分析可知,C点白色固体M为NaHCO3,需CO2体积为0.1 mol×22.4L?mol-1=2.24L,
故答案为:2.24L;
(3)图B点时M的质量为7.16 g,由于5.3<7.16<8.4,知M由Na2CO3和NaHCO3组成,设在B点时Na2CO3物质的量为x,NaHCO3物质的量为y,则:
|
解得x=0.02,y=0.06,
答:B点时,M的组成为0.02molNa2CO3、0.06molNaHCO3.
点评:本题以图象形式考查化学计算,难度中等,利用假设法判断A、C两点白色固体的成分是解题关键.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
下列有关操作及实验结论正确的是( )
| A、某溶液做焰色反应,现象为黄色,说明该溶液中不存在K+ |
| B、配制950mL1mol/LNa2CO3溶液时,应用托盘天平称取100.7g无水Na2CO3 |
| C、为证明酸性H2CO3>H2SiO3,可将CO2气体通入Na2SiO3溶液中观察现象 |
| D、用酒精萃取碘水中的I2 |
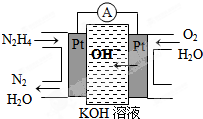

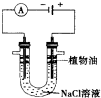 铁是一种过渡元素,金属铁是最常用的金属.请回答下列各题:
铁是一种过渡元素,金属铁是最常用的金属.请回答下列各题: