题目内容
9.下列叙述正确的是( )| A. | 次氯酸的电离方程式为:HClO═H++ClO- | |
| B. | c(H+)等于1×10-7mol•L-1的溶液一定是中性溶液 | |
| C. | 在CH3COONa溶液中,c(CH3COO-)<c(Na+) | |
| D. | 0.2mol•L-1CH3COOH溶液中的c(H+)是0.1mol•L-1 HCl溶液中的c(H+)的2倍 |
分析 A.次氯酸为弱酸,电离方程式应该用可逆号;
B.温度影响水的电离,只有氢离子与氢氧根离子的浓度相等时,溶液才呈中性;
C.醋酸根离子部分水解,导致醋酸根离子的浓度减小;
D.醋酸为弱酸,在溶液中部分电离出氢离子.
解答 解:A.次氯酸在溶液中部分电离出氢离子和次氯酸根离子,其正确的电离方程式为:HClO?H++ClO-,故A错误;
B.c(H+)等于1×10-7mol•L-1的溶液中,氢离子与氢氧根离子浓度不一定相等,则该溶液不一定是中性溶液,故B错误;
C.在CH3COONa溶液中,醋酸根离子部分水解,则c(CH3COO-)<c(Na+),故C正确;
D.0.2mol•L-1CH3COOH溶液中,醋酸只能部分电离出氢离子,则c(H+)小于0.2mol/L,0.1mol•L-1 HCl溶液中的c(H+)=0.1mol/L,故D错误;
故选C.
点评 本题考查了离子浓度大小比较、弱电解质的电离平衡及其影响,题目难度中等,明确电离平衡及其影响为解答关键,注意溶液酸碱性的判断方法,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.某有机物X的结构简式如图所示,则下列有关说法中不正确的是( )
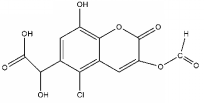

| A. | 能发生加成、取代、氧化反应 | |
| B. | 1 mol该物质最多可与7mol NaOH反应 | |
| C. | 1 mol该物质最多可与6 mol H2反应 | |
| D. | 能与FeCl3溶液发生显色反应 |
20.为了更好地解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻找新能源.以下做法不能提高燃料效率的是( )
| A. | 煤的气化与液化 | B. | 液体燃料呈雾状喷出 | ||
| C. | 通入大量的空气 | D. | 将煤块粉碎 |
14.如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )
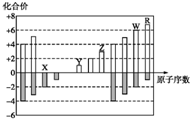

| A. | 离子原子半径:X2->Y+>Z3+ | |
| B. | 气态氢化物的沸点:X>R | |
| C. | 最高价氧化物的水化物的酸性:W>R | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
1.下列叙述中,正确的是( )
| A. | 10mL 质量分数为98%硫酸,用10mL 水稀释后,硫酸的质量分数小于49% | |
| B. | 向两等份不饱和的烧碱溶液中分别加入一定量的氧化钠和过氧化钠,使溶液均恰好饱和,则加入的氧化钠和过氧化钠的物质的量之比等于1:1(温度不变) | |
| C. | 36.5 克HCl 溶解在1L 水中,所得溶液的密度为ρ g/ml,质量分数为ω,物质的量溶液为c mol/L,则ω=36.5c/ρ | |
| D. | 上述36.5g HCl 气体占有的体积约为22.4L |
18.下列说法不正确的是( )
| A. | 稀醋酸中加入少量醋酸钠固体减小醋酸的电离程度 | |
| B. | 0.02 mol•L-1HCl溶液与0.02 mol•L-1Ba(OH)2溶液等体积混合后,溶液pH约为12 | |
| C. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 | |
| D. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
19.下列说法错误的是( )
| A. | 硝酸可以使蛋白质变黄,称为颜色反应,该过程为物理变化 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| C. | 酯化反应是可逆反应,为了提高反应速率,一般加入浓硫酸做催化剂 | |
| D. | 油脂在碱性条件下的水解反应称为皂化反应 |
 .
.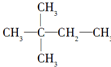 ,则A的结构简式为(CH3)3CCH=CH2.
,则A的结构简式为(CH3)3CCH=CH2. C:CH3COOH
C:CH3COOH