题目内容
9.氮及其化合物在生活、生产和科技等方面有重要的应用.(1)写出氮原子的原子结构示意图
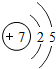 ;
;(2)氮氧化物是造成雾霾天气的主要原因之一,利用ClO2和Na2SO3溶液处理氮氧化物的反应过程如下:
NO$→_{反应Ⅰ}^{ClO_{2}}$NO2$→_{反应Ⅱ}^{Na_{2}SO_{3}溶液}$N2
反应Ⅱ的离子方程式是2NO2+4SO32-═N2+4SO42-;
(3)羟胺(NH2OH)可看成是氨分子内的1个氢原子被羟基取代后的产物,常用作还原剂,其水溶液显弱碱性.
①NH2OH的水溶液呈弱碱性的原理与NH3相似,NH2OH的水溶液中主要离子有NH3OH+、OH-(填离子符号).
②某离子化合物的组成元素与NH2OH相同,其水溶液显酸性.该物质是NH4NO3(填化学式),其溶液中离子浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(4)氨水在工业上用作沉淀剂.已知25℃时,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Al(OH)3]=1.0×10-32,向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水.当溶液中Fe3+和Al3+沉淀完全[c(Fe3+)、C(Al3+)均小于1.0×10-5mol•L-1]时,调节溶液的pH应略大于3.
分析 (1)氮原子的原子核内质子数为7,核外有2个电子层,第一层上有2个电子,第二层上有5个电子;
(2)二氧化氮具有氧化性,能氧化Na2SO3生成Na2SO4,本身被还原成氮气;
(3)①NH2OH的水溶液呈弱碱性的原理与NH3相似,根据氨水溶液中的一水合氨电离的方法判断;
②某离子化合物的组成元素与NH2OH相同,其水溶液显酸性,则该化合物为NH4NO3,该盐为强酸弱碱盐水解呈酸性,据此分析各离子浓度;
(4)根据Fe(OH)3、Al(OH)3的溶度积常数,分别计算当Fe3+、Al3+完全沉淀时,求出溶液中c(OH-),再求出c(H+),以此计算出溶液应调节的pH.
解答 解:(1)氮原子的原子核内质子数为7,用圆圈内的数字表示核内质子数,+号表示原子核带正电;弧线表示电子层,弧线上的数字表示该层上的电子数,所以其原子结构示意图为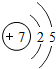 ,
,
故答案为: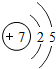 ;
;
(2)二氧化氮具有氧化性,能氧化Na2SO3生成Na2SO4,本身被还原成氮气,方程式为2NO2+4Na2SO3═N2+4Na2SO4,离子方程式为:2NO2+4SO32-═N2+4SO42-,
故答案为:2NO2+4SO32-═N2+4SO42-;
(3)①NH2OH的水溶液呈弱碱性的原理与NH3相似,NH2OH的水溶液存在平衡NH2OH•H2O?NH3OH++OH-,所以溶液中存在的主要离子有NH3OH+、OH-,
故答案为:NH3OH+、OH-;
②某离子化合物的组成元素与NH2OH相同,其水溶液显酸性,则该化合物为NH4NO3,为强酸弱碱盐,发生水解反应:NH4++H2O?NH3•H2O+H+,溶液呈酸性,溶液中各种离子的浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:NH4NO3;c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(4)当Fe3+完全沉淀时,c(Fe3+)=1.0×10-5,c(Fe3+)•(OH-)3=1.0×10-38,c(OH-)=$\root{3}{\frac{1.0×1{0}^{-38}}{1.0×1{0}^{-5}}}$=1×10-11mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L,PH=3,当Al3+完全沉淀时,c(Al3+)=1.0×10-5,c(Al3+)•(OH-)3=1.0×10-32,c(OH-)=$\root{3}{\frac{1.0×1{0}^{-32}}{1.0×1{0}^{-5}}}$=1×10-9mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-9}}$=10-5mol/L,PH=5,
所以调节溶液的pH应略大于3,
故答案为:3.
点评 本题考查较综合,涉及原子结构示意图、离子方程式书写、离子浓度大小比较、溶度积的计算等,注重高频考点的考查,综合性较强,题目难度中等.

 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案| A. | CH3-CH=CH2和CH3-CH2-CH=CH2 | B. | CH3-CH3和CH3-CH=CH2 | ||
| C. | CH3-CH2-CH3和CH3-CH=CH2 | D. | CH3-CH2-CH2-CH3和CH3-CH2-CHCl2 |
①偏铝酸钠溶液和盐酸②碳酸钠溶液与盐酸③硝酸银溶液与氨水④苯酚钠溶液与二氧化碳⑤碳酸氢钠溶液与澄清的石灰水⑥硫酸铝溶液与氨水.
| A. | ④⑥ | B. | ②④⑥ | C. | 仅有⑥ | D. | ①③ |
| A. | H2O | B. | CO2 | C. | NH3 | D. | H2O2 |
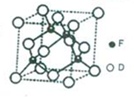 A、B、D、E、F是原子序数依次增大的五种前四周期元素,相关信息如下:
A、B、D、E、F是原子序数依次增大的五种前四周期元素,相关信息如下:| A | 原子半径最小的元素 |
| B | 原子核外电子有6种不同的运动状态 |
| E | 原子L电子层上有两个未成对电子 |
| F | 原子最外层有2个电子,次外层电子数为D原子最外层电子数的2倍 |
(2)B、D元素分别与A元素形成的最简单分子的VSERP模型分别为四面体形、四面体形(用文字描述),两者沸点较高的是NH3(填化学式),原因是氨气分子之间形成氢键,而甲烷分子之间不能形成氢键.
(3)F元素基态原子价电子排布图为
 ,能量最高的电子占据的能级符号为3d,该能级所在能层具有的原子轨道数为9.
,能量最高的电子占据的能级符号为3d,该能级所在能层具有的原子轨道数为9.(4)D、F形成的一种晶体,晶胞如图所示,该晶体化学式为TiN.已知晶体的密度为ρ g•cm-3,阿伏伽德罗常数为NA,则晶胞边长为$\root{3}{\frac{248}{ρ{N}_{A}}}$×1010pm.
| 组合分类 | 碱 | 酸 | 纯净物 | 碱性氧化物 | 酸性氧化物 |
| A | 烧碱 | H2SO4 | 盐酸 | CaO | SO3 |
| B | 纯碱 | HCl | 冰醋酸 | Na2O2 | CO2 |
| C | NaOH | CH3COOH | 冰水混合物 | Na2O | SO2 |
| D | KOH | HNO3 | 胆矾 | Al2O3 | CO |
| A. | A | B. | B | C. | C | D. | D |
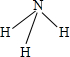 ,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为
,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为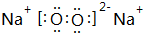 .
.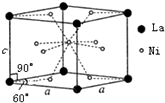 Ni和La的合金是目前使用广泛的储氢材料.该合金的晶胞结构如图所示.
Ni和La的合金是目前使用广泛的储氢材料.该合金的晶胞结构如图所示.