题目内容
中学化学中几种常见物质的转化关系如图所示(图中部分反应物或生成物及反应条件未列出).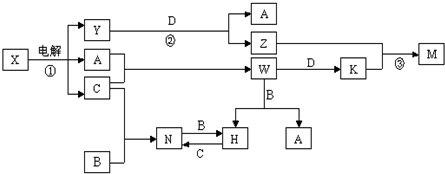
已知:A、B、C、D是单质,其余是化合物.其中B、D是生活中常用金属,其中D有变价.又知A在C中燃烧为苍白色火焰,M是一种氢氧化物,而且既可溶于盐酸又可溶于NaOH溶液.请回答下列问题:
(1)写出D的化学式 ,N的化学式 ;
(2)写出A+C→W的化学反应方程式: ;
(3)写出K溶液和过量氨水反应的化学方程式: ;
(4)在N的溶液中加入过量的单质R,静置,溶液呈蓝色,该实验证明氧化性弱的金属阳离子是 (写离子符号).

已知:A、B、C、D是单质,其余是化合物.其中B、D是生活中常用金属,其中D有变价.又知A在C中燃烧为苍白色火焰,M是一种氢氧化物,而且既可溶于盐酸又可溶于NaOH溶液.请回答下列问题:
(1)写出D的化学式
(2)写出A+C→W的化学反应方程式:
(3)写出K溶液和过量氨水反应的化学方程式:
(4)在N的溶液中加入过量的单质R,静置,溶液呈蓝色,该实验证明氧化性弱的金属阳离子是
考点:无机物的推断
专题:推断题
分析:A在C中点燃有苍白色火焰,应为H2在Cl2中的燃烧,则A为H2,C为Cl2,W为HCl,应为电解饱和食盐水的反应,则X为饱和NaCl溶液,Y为NaOH,能与NaOH反应生成H2的金属为Al,则D为Al,Z为NaAlO2,K为AlCl3,M为Al(OH)3,由转化关系可知B应为变价金属,应为Fe,则N为FeCl3,H为FeCl2,结合物质的性质以及题目的要求解答该题.
解答:
解:A在C中点燃有苍白色火焰,应为H2在Cl2中的燃烧,则A为H2,C为Cl2,W为HCl,应为电解饱和食盐水的反应,则X为饱和NaCl溶液,Y为NaOH,能与NaOH反应生成H2的金属为Al,则D为Al,Z为NaAlO2,K为AlCl3,M为Al(OH)3,由转化关系可知B应为变价金属,应为Fe,则N为FeCl3,H为FeCl2,
(1)由以上分析可知D为Al,N为FeCl3,故答案为:Al;FeCl3;
(2)A+C→W的化学反应方程式H2+Cl2
2HCl,故答案为:H2+Cl2
2HCl;
(3)K为AlCl3,氨水为弱碱的水溶液,二者反应只生成Al(OH)3,反应的化学方程式为AlCl3+3NH3?H2O═Al(OH)3↓+3NH4Cl,
故答案为:AlCl3+3NH3?H2O═Al(OH)3↓+3NH4Cl;
(4)在N的溶液中加入过量的单质R,静置,溶液呈蓝色,灼热R为Cu,反应为2Fe3++Cu=2Fe2++Cu2+,氧化性较弱的离子为Cu2+,故答案为:Cu2+.
(1)由以上分析可知D为Al,N为FeCl3,故答案为:Al;FeCl3;
(2)A+C→W的化学反应方程式H2+Cl2
| ||
| ||
(3)K为AlCl3,氨水为弱碱的水溶液,二者反应只生成Al(OH)3,反应的化学方程式为AlCl3+3NH3?H2O═Al(OH)3↓+3NH4Cl,
故答案为:AlCl3+3NH3?H2O═Al(OH)3↓+3NH4Cl;
(4)在N的溶液中加入过量的单质R,静置,溶液呈蓝色,灼热R为Cu,反应为2Fe3++Cu=2Fe2++Cu2+,氧化性较弱的离子为Cu2+,故答案为:Cu2+.
点评:本题考查无机物的推断,题目难度中等,根据物质的典型性质,明确物质的种类为解答该题的关键,题中注意以A在C中点燃有苍白色火焰为突破口,注意工业电解饱和食盐水的重要应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
甲醛,乙醛,丙醛组成的混和物中,氢元素占质量百分组成为9%,则混和物中氧元素占质量百分组成为
( )
( )
| A、37% | B、16% |
| C、6.6% | D、无法确定 |
工业上用来制取金属镁的方法是( )
| A、用氢气还原氧化镁 |
| B、电解氯化镁溶液 |
| C、电解熔融的氯化镁 |
| D、用木炭还原氧化镁 |
电解质电离时,一定相等的是( )
| A、阴、阳离子的个数 |
| B、阴、阳离子的质量 |
| C、每个阳离子与阴离子所带的电荷 |
| D、正电荷总数与负电荷总数 |
工业上制硫酸,重要的一步是:2SO2+O2
2SO3,△H<0 从以下事实中找出不能应用勒夏特列原理解释的是( )
| ||
| V2O3 |
| A、.温度过高对提高产率不利 |
| B、.在高压下进行是有利于正反应 |
| C、在高温下进行和加入催化剂都能使化学反应速率加快 |
| D、.增大O2的浓度可提高平衡混合物中SO3的质量 |
