题目内容
8.设NA表示阿伏加徳罗常数,下列叙述中正确的是( )| A. | 1L 1mol•L-1的盐酸溶液中,所含氯化氢分子数为NA | |
| B. | 11.2L氧气中所含有的原子数为NA | |
| C. | 常温常压下42g乙烯和丁烯混合气体中,极性键数为6NA | |
| D. | 1L0.lmol/L 的 Fe2(SO4)3 溶液中,Fe3+的数目为 0.2NA |
分析 A.氯化氢为强电解质,在溶液中完全电离,溶液中不存在氯化氢分子;
B.没有告诉在标况下,不能使用标况下的气体摩尔体积计算;
C.乙烯和丁烯中含有的极性键为碳氢键,结合二者的最简式CH2计算该混合物中含有的极性键;
D.铁离子发生水解,导致铁离子数目减少.
解答 解:A.HCl在溶液中完全电离出氯离子和氢离子,盐酸中不存在HCl分子,故A错误;
B.不是标况下,不能使用标准状况下的气体摩尔体积计算氧气的物质的量,故B错误;
C.42g乙烯和丁烯混合气体中含有42g最简式CH2,则该混合物中含有最简式CH2的物质的量为:$\frac{42g}{14g/mol}$=3mol,含有H的物质的量为6mol,该混合物中含有的极性键为碳氢键,则极性键的物质的量取决于H的物质的量,则该混合物中含有6mol极性键,含有的极性键数为6NA,故C正确;
D.1L 0.lmol/L 的 Fe2(SO4)3 溶液中含有硫酸铁的物质的量为:0.1mol/L×1L=0.1mol,由于铁离子部分水解,则溶液中含有铁离子的物质的量小于0.2mol,含有Fe3+的数目小于0.2NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
18.25℃时,把0.2mol•L-1的醋酸加水稀释,则图中的纵轴y表示的是( )
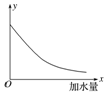

| A. | 溶液中OH-的物质的量浓度 | B. | 溶液的导电能力 | ||
| C. | 溶液中的$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ | D. | CH3COOH的电离程度 |
16.根据下列实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作与现象 | 结论 |
| A | 向油脂皂化反应后的溶液中滴入酚酞,溶液变红 | 油脂已经完全皂化 |
| B | 蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,有光亮的银生成 | 蔗糖溶液已经水解完全 |
| C | 向溶液X中滴入NaHCO3溶液,产生无色气体 | X中的溶质一定是酸 |
| D | 向鸡蛋清溶液中滴加醋酸铅溶液,产生白色沉淀,加水沉淀不消失 | 蛋白质发生了变性 |
| A. | A | B. | B | C. | C | D. | D |
13.下列实验操作中正确的是( )
| A. | 用25 mL量筒量取4.0 mol/L的盐酸5.62 mL | |
| B. | 做蒸馏操作时,冷凝水方向是下进上出 | |
| C. | 用溶解、过滤、蒸发的方法分离氯化钠与硝酸钾的混合物 | |
| D. | 用蒸发皿灼烧胆矾(CuSO4•5H2O)得到CuSO4 |
17.下列各组离子一定能大量共存的是( )
| A. | 在无色溶液中:NH4+、MnO4-、SO42-、CO32- | |
| B. | 在含大量 Ba2+的溶液中:NH4+、Na+、Cl-、OH- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、SO32- | |
| D. | 在 pH=1 的溶液中:K+、Fe2+、Cl-、CH3COO- |

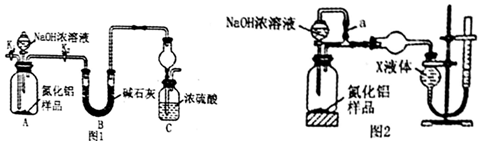
 有机物的结构可用键线式简化表示,如CH3-CH═CH-CH3可表示为
有机物的结构可用键线式简化表示,如CH3-CH═CH-CH3可表示为 有一种有机物X的键线式如图所示.
有一种有机物X的键线式如图所示. .
.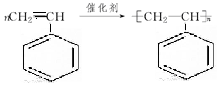 .
. .
.