题目内容
工业上冶炼冰铜(mCu2O?nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体.

(1)气体A中的大气污染物可选用下列试剂中的 (填序号)吸收.
a.浓H2SO4 b.浓HNO3 c. NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加 (填物质名称)溶液后呈红色,说明溶液中存在Fe3+,检验溶液中还存在Fe2+的方法是 (注明试剂、现象).实验室可用如图的装置完成泡铜冶炼粗铜的反应.
(3)泡铜冶炼粗铜的化学方程式是 .


(1)气体A中的大气污染物可选用下列试剂中的
a.浓H2SO4 b.浓HNO3 c. NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加
(3)泡铜冶炼粗铜的化学方程式是

考点:铜金属及其重要化合物的主要性质
专题:实验设计题
分析:(1)气体A为SO2,可用碱液吸收;
(2)检验溶液中存在Fe3+,可用KSCN,Fe2+具有还原性,可用酸性高锰酸钾溶液检验;
(3)Cu2O与Al在高温下反应生成Cu和Al2O3,为铝热反应.
(2)检验溶液中存在Fe3+,可用KSCN,Fe2+具有还原性,可用酸性高锰酸钾溶液检验;
(3)Cu2O与Al在高温下反应生成Cu和Al2O3,为铝热反应.
解答:
解:(1)气体A为SO2,可用碱液吸收,则应用NaOH或氨水,故答案为:cd;
(2)检验溶液中存在Fe3+,可用KSCN,溶液变成红色,Fe2+具有还原性,可用酸性高锰酸钾溶液检验,操作为另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+,
故答案为:硫氰化钾;另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+;
(3)Cu2O与Al在高温下反应生成Cu和Al2O3,反应的方程式为3Cu2O+2Al
6Cu+Al2O3,
故答案为:3Cu2O+2Al
6Cu+Al2O3.
(2)检验溶液中存在Fe3+,可用KSCN,溶液变成红色,Fe2+具有还原性,可用酸性高锰酸钾溶液检验,操作为另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+,
故答案为:硫氰化钾;另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+;
(3)Cu2O与Al在高温下反应生成Cu和Al2O3,反应的方程式为3Cu2O+2Al
| ||
故答案为:3Cu2O+2Al
| ||
点评:本题综合考查制备实验的涉及以及物质的分离提纯知识,侧重于综合考查学生的实验能力和数据分析能力,注意把握实验原理和实验方法,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、金属氧化物都能与水反应生成碱 |
| B、非金属氧化物都能与水反应生成酸 |
| C、氧化铝既能与酸反应又能与氨水反应 |
| D、氧化铝坩埚不能用于熔融烧碱 |
铜易生锈,铜合金更易生锈,铜器上往往覆盖着一层铜绿,铜绿的主要成分是( )
| A、CuO |
| B、Cu(OH)2 |
| C、Cu2O |
| D、Cu2(OH)2CO3 |


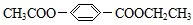 如图是A、B分别经①、②两步反应得到各种产物的相互关系示意图,请回答下列问题:
如图是A、B分别经①、②两步反应得到各种产物的相互关系示意图,请回答下列问题: