题目内容
1.已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中的信息,回答下列问题:| 溶质的物质的量浓度/mol•L-1 | 溶液的密度/g•cm-3 | 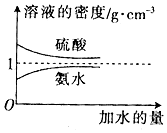 | |
| 硫酸 | c1 | ρ1 | |
| 氨水 | c2 | ρ2 |
(2)物质的量浓度为c1mol•L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为0.5c1mol•L-1.
(3)物质的量浓度为c2mol•L-1的氨水与$\frac{1}{5}$c2mol•L-1的氨水等质量混合,所得溶液的密度大于(填“大于”、“小于”或“等于”,下同) ρ2g•cm-3,所得溶液的物质的量浓度大于$\frac{3}{5}$c2mol•L-1(设混合后溶液的体积变化忽略不计)
(4)若将稀硫酸与氨水混合,写出其反应的离子方程式NH3•H2O+H+=NH4++H2O.
分析 (1)根据c=$\frac{1000ρω}{M}$进行公式变形计算;
(2)根据稀释定律,稀释前后溶质硫酸的物质的量不变,据此计算稀释后溶液的浓度;
(3)c2 mol•L-1的氨水与$\frac{1}{5}$c2 mol•L-1的氨水等质量混合,混合后溶液的浓度小于c2 mol•L-1的氨水,由图可知,氨水的浓度越大密度越小,据此判断混合后溶液的密度与ρ2 g•cm-3关系;物质的量浓度分别为c2 mol•L-1和$\frac{1}{5}$c2 mol•L-1的氨水等质量混合,令c2 mol•L-1和$\frac{1}{5}$c2 mol•L-1的氨水的体积分别为aL、bL,混合后溶液的体积为(a+b)L,表示出混合后氨水的物质的量浓度,氨水的浓度越大密度越小,根据V=$\frac{m}{ρ}$可知a>b,据此判断;
(4)稀硫酸与氨水反应生成硫酸铵,离子反应方程式为:NH3•H2O+H+=NH4++H2O;
解答 解:(1)根据c=$\frac{1000ρω}{M}$进行公式可知,硫酸的质量分数ω=$\frac{98{c}_{1}}{1000{ρ}_{1}}$,故答案为:$\frac{98{c}_{1}}{1000{ρ}_{1}}$;
(2)令硫酸与水的体积为VL,则混合后溶液的总体积为2VL,根据稀释定律,稀释前后溶质硫酸的物质的量不变,稀释后硫酸溶液的浓度为$\frac{VL×{c}_{1}mol/L}{2VL}$=0.5c1mol/L,故答案为:0.5c1;
(3)c2 mol•L-1的氨水与$\frac{1}{5}$c2 mol•L-1的氨水等质量混合,混合后溶液的浓度小于c2 mol•L-1的氨水,由图可知,氨水的浓度越大密度越小,故混合后溶液的密度大于ρ2 g•cm-3,物质的量浓度分别为c2 mol•L-1和$\frac{1}{5}$c2 mol•L-1的氨水等质量混合,令c2 mol•L-1和$\frac{1}{5}$c2 mol•L-1的氨水的体积分别为aL、bL,混合后溶液的体积为(a+b)L,混合后氨水的物质的量浓度为$\frac{a{c}_{2}+b×\frac{1}{5}{c}_{2}}{a+b}$=c2-$\frac{\frac{4}{5}{c}_{2}}{1+\frac{a}{b}}$,氨水的浓度越大密度越小,根据V=$\frac{m}{ρ}$可知a>b,故$\frac{\frac{4}{5}{c}_{2}}{1+\frac{a}{b}}$<$\frac{2}{5}$c2,故c2-$\frac{\frac{4}{5}{c}_{2}}{1+\frac{a}{b}}$>$\frac{3}{5}$c2,故答案为:大于;大于;
(4)稀硫酸与氨水反应生成硫酸铵,离子反应方程式为:NH3•H2O+H+=NH4++H2O,故答案为:NH3•H2O+H+=NH4++H2O.
点评 本题考查物质的量浓度的有关计算,难度中等,理解根据定义式进行的计算,(3)为易错点,注意氨水的浓度越大密度越小.

 名校课堂系列答案
名校课堂系列答案| A. | CH3CH2CH2CH2CH3和CH3CH(CH3)2 | B. | CH2=C(CH3)2和CH2=CHCH=CH2 | ||
| C. | O2和O3 | D. | CH3CH2OH和CH3-O-CH3 |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4.下列结论正确的是( )
| A. | ①②③均是氧化还原反应 | |
| B. | 反应②中氧化剂与还原剂的物质的量之比为1:6 | |
| C. | 氧化性强弱顺序是:K2Cr2O7>I2>Fe2(SO4)3 | |
| D. | 反应③中0.1mol还原剂共失去电子数为0.5NA |
| A. | MgCl2 的摩尔质量为95 g | |
| B. | 常温常压下,1 mol CO2的质量是44 g | |
| C. | 标准状况下,1 mol H2O所占的体积约为22.4 L | |
| D. | 100 mL 1mol/L的稀硫酸中含有H+ 的数目约为6.02×1022 |
(2)填表:(类别选填“单质”、“氧化物”、“酸”、“碱”、“盐:
| 名称 | 氢氧化镁 | 银 | |
| 化学式 | HNO3 | Mg(OH)2 | |
| 类别 | 酸 | 单质 |
| A. | 制造炊具 | B. | 制儿童玩具油漆 | C. | 制牙膏皮 | D. | 炼铝厂制造铝锭 |
| A. | H++OH -=H2O | |
| B. | Cl -+Ag+=AgCl↓ | |
| C. | Cu 2++2OH -+Ba 2++SO42-=BaSO4↓+Cu(OH)2↓ | |
| D. | H++SO42-+OH-+Ba 2+=BaSO4↓+H2O |
| A. | CaH2+2H2O═Ca(OH)2+2H2↑ | B. | 2F2+2H2O═4HF+O2 | ||
| C. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | D. | 2Na2O2+H2O═4NaOH+O2↑ |