题目内容
在能与铝单质反应生成氢气的某溶液中,可能大量共存的离子组是( )
①K+、Cl-、NO3-、SO42- ②K+、Fe2+、I-、NO3- ③NH4+、Cl-、Mg2+、SO42-④Na+、Ca2+、Cl-、HCO3- ⑤K+、Al3+、Cl-、CO32-.
①K+、Cl-、NO3-、SO42- ②K+、Fe2+、I-、NO3- ③NH4+、Cl-、Mg2+、SO42-④Na+、Ca2+、Cl-、HCO3- ⑤K+、Al3+、Cl-、CO32-.
| A、①③ | B、③⑤ | C、③④ | D、②⑤ |
考点:离子共存问题
专题:
分析:与铝单质反应生成氢气的某溶液,为非氧化性酸或强碱溶液,根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,以此来解答.
解答:
解:与铝单质反应生成氢气的某溶液,为非氧化性酸或强碱溶液,
①酸溶液中H+、Al、NO3-发生氧化还原反应不生成氢气,而碱性溶液中该组离子之间不反应,可共存,故选;
②酸性溶液中H+、Fe2+(或I-)、NO3- 发生氧化还原反应,碱性溶液中不能大量存在Fe2+,一定不能共存,故不选;
③碱性溶液中不能大量存在NH4+、Mg2+,酸性溶液中该组离子之间不反应,可大量共存,故选;
④酸或碱性溶液均不能大量存在HCO3-,故不选;
⑤Al3+、CO32-相互促进水解,不能大量共存,酸性溶液中不能大量存在CO32-,碱性溶液中不能大量存在Al3+,故不选;
故选A.
①酸溶液中H+、Al、NO3-发生氧化还原反应不生成氢气,而碱性溶液中该组离子之间不反应,可共存,故选;
②酸性溶液中H+、Fe2+(或I-)、NO3- 发生氧化还原反应,碱性溶液中不能大量存在Fe2+,一定不能共存,故不选;
③碱性溶液中不能大量存在NH4+、Mg2+,酸性溶液中该组离子之间不反应,可大量共存,故选;
④酸或碱性溶液均不能大量存在HCO3-,故不选;
⑤Al3+、CO32-相互促进水解,不能大量共存,酸性溶液中不能大量存在CO32-,碱性溶液中不能大量存在Al3+,故不选;
故选A.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应、水解反应的离子共存考查,综合性较强,题目难度不大.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
反应CO+H2O (g)?CO2+H2在800℃达到平衡时分别改变下列条件,K值发生变化的是( )
| A、将压强减小至原来的一半 |
| B、将反应温度升高至100℃ |
| C、添加催化剂 |
| D、增大水蒸气的浓度 |
在含有FeCl3和BaCl2的酸性溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN溶液,无明显现象,下列叙述正确的是( )
| A、白色沉淀是BaSO4和BaSO3 |
| B、溶液的酸性减弱 |
| C、白色沉淀是BaSO3 |
| D、溶液中Fe3+全部被还原为Fe2+ |
下列各变化中属于原电池的反应的是( )
| A、在空气中金属铝表面迅速氧化形成保护层 |
| B、镀锌铁表面锌有划损时,也能阻止铁被氧化 |
| C、红热的铁丝与冷水接触,表面表成蓝黑色保护层 |
| D、锌和稀硫酸反应时,加入少量的蒸馏水可使反应减慢 |
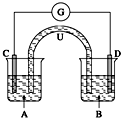 已知:2Fe3++SO32-+H2O?2Fe2++SO42-+2H+.如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源负极.A杯中为FeCl3溶液;B杯中为Na2SO3溶液.以下关于该装置的说法错误的是( )
已知:2Fe3++SO32-+H2O?2Fe2++SO42-+2H+.如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源负极.A杯中为FeCl3溶液;B杯中为Na2SO3溶液.以下关于该装置的说法错误的是( )| A、G的指针指向D极 |
| B、U中阳离子向A极移动 |
| C、一段时间后,化学反应达到平衡状态,导线中无电流通过 |
| D、一段时间后,B中溶液pH增大 |
测定有机物中元素的方法很多,如元素分析仪.下列叙述合适的是( )
| A、铜丝燃烧法可测定是否含有卤素 |
| B、钠融法不能测定氯、溴 |
| C、CuO 不能氧化有机物 |
| D、最简式就是结构简式,一般是通过计算得出的,实验式不等于结构简式或最简式 |
设NA为阿伏加德罗常数,则下列说法正确的是( )
| A、标准状况下,2.24LCHCl3含有的分子数为0.1NA |
| B、1.6g甲烷完全燃烧生成二氧化碳和水,转移的电子数为0.4NA |
| C、0.1mol乙炔分子中含有的共用电子对数目为0.3NA |
| D、14g乙烯和环丙烷混合物中含有的原子数目为3NA |