题目内容
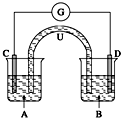 已知:2Fe3++SO32-+H2O?2Fe2++SO42-+2H+.如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源负极.A杯中为FeCl3溶液;B杯中为Na2SO3溶液.以下关于该装置的说法错误的是( )
已知:2Fe3++SO32-+H2O?2Fe2++SO42-+2H+.如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源负极.A杯中为FeCl3溶液;B杯中为Na2SO3溶液.以下关于该装置的说法错误的是( )| A、G的指针指向D极 |
| B、U中阳离子向A极移动 |
| C、一段时间后,化学反应达到平衡状态,导线中无电流通过 |
| D、一段时间后,B中溶液pH增大 |
考点:原电池和电解池的工作原理
专题:
分析:由方程式2Fe3++SO32-+H2O?2Fe2++SO42-+2H+可知,当正向移动时,Fe3+反应中被还原,应为原电池正极反应,SO32-被氧化,应为原电池负极反应,以此解答该题.
解答:
解:A.SO32-被氧化,应为原电池负极反应,G是灵敏电流计,其指针总是偏向电源负极,则G的指针指向D极,故A正确;
B.A为正极,原电池工作时,阳离子向正极移动,故B正确;
C.为可逆反应,正逆反应进行的程度相同,反应达到平衡状态,导线中无电流通过,故C正确;
D.B为负极,电极方程式为SO32--2e-+H2O=SO42-+2H+,则pH减小,故D错误.
故选D.
B.A为正极,原电池工作时,阳离子向正极移动,故B正确;
C.为可逆反应,正逆反应进行的程度相同,反应达到平衡状态,导线中无电流通过,故C正确;
D.B为负极,电极方程式为SO32--2e-+H2O=SO42-+2H+,则pH减小,故D错误.
故选D.
点评:本题考查学生原电池的工作原理,为高频考点,侧重学生的分析能力的考查,注意根据方程式从氧化还原反应的角度认识原电池的反应原理,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 上海世博会某省馆设计标新立异,其外型是由三个大小不等的青花瓷容器组成(如图),陶姿是( )
上海世博会某省馆设计标新立异,其外型是由三个大小不等的青花瓷容器组成(如图),陶姿是( )| A、金属材料 | B、无机非金属材料 |
| C、复合材料 | D、合成材料 |
在能与铝单质反应生成氢气的某溶液中,可能大量共存的离子组是( )
①K+、Cl-、NO3-、SO42- ②K+、Fe2+、I-、NO3- ③NH4+、Cl-、Mg2+、SO42-④Na+、Ca2+、Cl-、HCO3- ⑤K+、Al3+、Cl-、CO32-.
①K+、Cl-、NO3-、SO42- ②K+、Fe2+、I-、NO3- ③NH4+、Cl-、Mg2+、SO42-④Na+、Ca2+、Cl-、HCO3- ⑤K+、Al3+、Cl-、CO32-.
| A、①③ | B、③⑤ | C、③④ | D、②⑤ |
下列事实与氢键无关的是( )
| A、氨和水反应生成NH3?H2O |
| B、DNA双螺旋结构 |
| C、水在高温下分解成氢气和氧气 |
| D、乙醇比二甲醚易溶于水 |
0.5molH2SO4中大约含有( )
| A、0.5×6.02×1023 个H2SO4分子 |
| B、0.5×6.02×1023 个H2分子 |
| C、6.02×1023 个氢原子 |
| D、0.5×6.02×1023×50个质子 |
 如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:
如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答: