题目内容
某有机样品3.1g完全燃烧,燃烧后的混合物通入过量的澄清石灰水,石灰水共增重7.1g,经过滤得到10g沉淀.该有机样品是( )
| A、乙二醇(C2H6O2) |
| B、乙醇 |
| C、乙醛 |
| D、甲烷和丙烷(C3H8)的混合物 |
考点:有机物实验式和分子式的确定
专题:
分析:石灰水共增重7.1g,为燃烧生成的二氧化碳与水的质量,10g沉淀为碳酸钙的质量.
有机物中的碳全部转化为二氧化碳,有机物中的氢全部转化为水,计算二氧化碳、水的物质的量,进而计算C元素、H元素的质量,根据质量守恒判断有机物中是否含有氧元素,根据原子守恒计算有机物的最简式,结合选项判断.
有机物中的碳全部转化为二氧化碳,有机物中的氢全部转化为水,计算二氧化碳、水的物质的量,进而计算C元素、H元素的质量,根据质量守恒判断有机物中是否含有氧元素,根据原子守恒计算有机物的最简式,结合选项判断.
解答:
解:l0g沉淀为CaCO3,物质的量为
=0.1mol,根据碳元素守恒可知,产生的二氧化碳为0.1mol,二氧化碳的质量为0.1mol×44g/mol=4.4g,其中碳元素质量为:0.1mol×12g/mol=1.2g,
石灰水增重7.1g,所以有机物燃烧生成的水的质量为:7.1-4.4=2.7g,物质的量为
=0.15mol;氢元素质量为0.3mol×1g/mol=0.3g,
有机样品共3.1g,所以O元素物质的质量=3.1g-1.2g-0.3g=1.6g,氧原子物质的量为:
=0.1mol.
即3.1g有机物中n(C)=0.1mol,n(H)=0.15mol×2=0.3mol,n(O)=0.1mol,碳、氢、氧原子的物质的量之比为0.1mol:0.3mol:0.1mol=1:3:1,即最简式为CH3O,只有乙二醇符合,
故选A.
| 10g |
| 100g/mol |
石灰水增重7.1g,所以有机物燃烧生成的水的质量为:7.1-4.4=2.7g,物质的量为
| 2.7g |
| 18g/mol |
有机样品共3.1g,所以O元素物质的质量=3.1g-1.2g-0.3g=1.6g,氧原子物质的量为:
| 1.6g |
| 16g/mol |
即3.1g有机物中n(C)=0.1mol,n(H)=0.15mol×2=0.3mol,n(O)=0.1mol,碳、氢、氧原子的物质的量之比为0.1mol:0.3mol:0.1mol=1:3:1,即最简式为CH3O,只有乙二醇符合,
故选A.
点评:本题考查有机物分子式的确定,难度中等,根据质量守恒确定有机物的是否含有氧元素是关键,考查学生的解决问题的能力.

练习册系列答案
相关题目
下列说法正确的是( )
| A、用加热法可除去Na2CO3中的NaHCO3 |
| B、Na、Mg、Fe等金属在一定条件下与水反应都生成H2和对应的碱 |
| C、可用石灰水区分Na2CO3与NaHCO3溶液 |
| D、浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
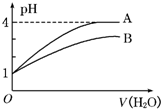 常温下pH=1的两种一元酸溶液A和B,分别加水稀释至1000倍,其pH与所加水的体积变化如图所示,则下列结论中正确的是( )
常温下pH=1的两种一元酸溶液A和B,分别加水稀释至1000倍,其pH与所加水的体积变化如图所示,则下列结论中正确的是( )| A、A酸比B酸的电离程度小 |
| B、pH=1时,B酸的物质的量浓度比A酸大 |
| C、B酸比A酸容易电离 |
| D、A是强碱,B是弱碱 |
在乙醇发生的各种反应中,断键方式不正确的是( )


| A、与金属钠反应时,键①断裂 |
| B、与醋酸、浓硫酸共热时,键②断裂 |
| C、与HCl反应生成氯乙烷时,键②断裂 |
| D、与浓硫酸共热至170℃时,键②和④断裂 |
下列叙述不正确的是( )
| A、石油的裂化和裂解可以得到烯烃 |
| B、石油的催化重整是获得芳香烃的主要途径 |
| C、石油分馏出的各馏分均是纯净物 |
| D、煤干馏产生的煤焦油经分馏可得到芳香烃 |
常温下,浓度均为0.1mol?L-1的6种盐溶液pH如下,下列说法正确的是( )
| 溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaClO |
| pH | 11.6 | 9.7 | 12.3 | 10.0 | 4.0 | 10.3 |
| A、电离能力:HCO3->HSO3->HClO |
| B、结合H+的能力:SiO32->CO32->SO32- |
| C、6种溶液中,Na2SiO3溶液中水的电离程度最小 |
| D、若要增大新制饱和氯水中HClO的浓度,可向其中加入Na2SiO3或Na2SO3 |