题目内容
(12分)某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,进行如下实验:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入适量的稀硫酸,溶液立即变蓝;
(1)写出实验①中发生反应的离子方程式 。
实验②:取适量实验①后的溶液,滴加4 mL 0.5 mol·L—1的亚硫酸钠溶液,蓝色恰好完全褪去。
(2)实验②化学反应中转移电子的物质的量是 。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是 。
实验③:取适量实验①后的溶液,继续滴加次氯酸钠溶液,溶液由蓝色变为无色,生成物之一为食盐加碘的原料。
(4)写出实验③中发生反应的离子方程式 。
(5)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-= Cu2+,还原反应式:2Fe3++2e-= 2Fe2+。据此,将反应2Al+2OH—+2H2O = 2AlO2—+3H2↑拆写为两个“半反应式”:氧化反应式: ,还原反应式: 。
(1)ClO-+2I-+2H+=I2+Cl-+H2O(2分)
(2)0.004 mol (没单位给1分) (2分)
(3)SO42-、I2、ClO-(2分)
(4)I2+5ClO—+H2O=2IO3—+5Cl—+2H+ (或I2+5ClO—+2O H—=2IO3—+5Cl—+H2O)(2分)
(5)2Al+8OH—-6e-=2AlO2—+4H2O(或Al+4OH—-3e-=AlO2—+2H2O)(2分),
6 H2O+6e-=6OH—+3H2↑(2 H2O+2e-=2OH—+2H2↑)(2分)。
【解析】
试题分析:(1)在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入适量的稀硫酸,溶液立即变蓝,发生反应的离子方程式ClO-+2I-+2H+=I2+Cl-+H2O;(2)实验②:取适量实验①后的溶液,滴加4 mL 0.5 mol·L—1的亚硫酸钠溶液,蓝色恰好完全褪去,发生的反应为I2 + SO32-+H2O ==== SO42-+2I- + 2H+ ,化学反应中转移电子的物质的量是0.004 mol;(3) 根据氧化剂的氧化性大于氧化产物的氧化性结合以上实验的反应方程式判断,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是SO42-、I2、ClO-;(4)实验③:取适量实验①后的溶液,继续滴加次氯酸钠溶液,溶液由蓝色变为无色,生成物之一为食盐加碘的原料,反应的离子方程式I2+5ClO—+H2O=2IO3—+5Cl—+2H+ (或I2+5ClO—+2O H—=2IO3—+5Cl—+H2O);(5)根据题给信息将反应2Al+2OH—+2H2O = 2AlO2—+3H2↑拆写为两个“半反应式”:氧化反应式:2Al+8OH—-6e-=2AlO2—+4H2O(或Al+4OH—-3e-=AlO2—+2H2O),还原反应式:6 H2O+6e-=6OH—+3H2↑(2 H2O+2e-=2OH—+2H2↑)。
考点:考查离子方程式的书写,氧化还原反应。

 天天向上口算本系列答案
天天向上口算本系列答案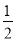 H2(g)+
H2(g)+
 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大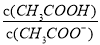 的值减小
的值减小