题目内容
6.N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)═4NO2(g)+O2(g)△H>0.一定温度时,向密闭容器中通入N2O5,部分实验数据见表:下列说法中错误的是( )| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol/L | 0.50 | 0.35 | 0.25 | 0.25 |
| A. | 500s时O2的浓度为0.075mol/L | |
| B. | 平衡后,升高温度,正反应速率先增大后减小 | |
| C. | 平衡后,要使平衡常数增大,改变的条件是升高温度 | |
| D. | 1000s时将容器的体积缩小一半,重新达到平衡时0.25mol/L<c(N2O5)<0.50mol/L |
分析 A.计算N2O5的浓度变化量,浓度变化量之比等于化学计量数之比,据此计算氧气浓度;
B.升高温度反应速率加快,而后N2O5的浓度减小,反应速率又降低;
C.要使平衡常数增大,应改变温度使平衡正向移动,正反应为吸热反应,应升高温度;
D.1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,其他条件不变,将容器的体积缩小一半,若平衡不移动,此时N2O5的浓度为5mol/L,由于体积减小,压强增大,平衡向逆反应方向移动.
解答 解:A.500s内N2O5的浓度变化量=0.5mol/L-0.35mol/L=0.15mol/L,浓度变化量之比等于化学计量数之比,故c(O2)=$\frac{1}{2}$△c(N2O5)=0.075 mol/L,故A正确;
B.升高温度反应速率加快,而后N2O5的浓度减小,反应速率又降低,故B正确;
C.要使平衡常数增大,应改变温度使平衡正向移动,正反应为吸热反应,应升高温度,故C正确;
D.1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,其他条件不变,将容器的体积缩小一半,若平衡不移动,此时N2O5的浓度为5mol/L,由于体积减小,压强增大,平衡向逆反应方向移动,则达到新平衡时c(N2O5)>5.00 mol•L-1,故D错误,
故选D.
点评 本题考查化学反应速率计算、化学平衡有关计算、化学平衡影响因素等,侧重考查学生分析计算能力,难度中等,注意对基础知识的理解掌握.

纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法I | 用碳粉在高温条件下还原CuO |
方法II | 用肼(N2H4)还原新制Cu(OH)2 |
方法III | 电解法,反应为2Cu+H2O |
(1)已知:2Cu(s)+ O2(g)=Cu2O(s)△H=﹣akJ•mol﹣1
O2(g)=Cu2O(s)△H=﹣akJ•mol﹣1
C(s)+ O2(g)=CO(g)△H=﹣bkJ•mol﹣1
O2(g)=CO(g)△H=﹣bkJ•mol﹣1
Cu(s)+ O2(g)=CuO(s)△H=﹣ckJ•mol﹣1
O2(g)=CuO(s)△H=﹣ckJ•mol﹣1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H= kJ•mol﹣1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因: .
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.
该制法的化学方程式为 .
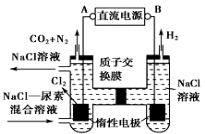
(4)方法III采用离子交换膜控制电解液中OH﹣的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理 .

(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g) 2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
变化如下表所示.
序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 (填字母代号).
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10﹣5mol•L﹣1•min﹣1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
将A和B加入密闭容器中,在一定条件下发生反应:A(g)+B(s) 2C(g),忽略固体体积,平衡时C的体积分数
2C(g),忽略固体体积,平衡时C的体积分数 (%)随温度和压强的变化如下表所示:
(%)随温度和压强的变化如下表所示:
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
800 | 54.0 | a | b |
900 | c | 75.0 | d |
1000 | e | f | 83.0 |
①a﹤b ②该反应的熵变△S﹤0 ③900℃、2.0MPa时A的转化率为60%
④K(1000℃)﹥K(800℃) ⑤正反应为吸热反应 上述①~⑤中正确的有( )
A.4个 B.3个 C.2个 D.1个
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 680 | 533 | 409 |
(2)上述平衡体系中加入苯,平衡向逆反应方向移动(填“正反应”或“逆反应”);
(3)温度一定,向上述平衡体系中加入少量KI固体,平衡常数不变(填“增大”或“减少”或“不变”).
| A. | 在饱和氯水中通入H2S气体,溶液的pH变小 | |
| B. | 在饱和氯水中通入SO2气体,溶液的pH变小 | |
| C. | 在饱和氯水中加入CaCO3,平衡向右移,溶液的pH变大 | |
| D. | 在饱和氯水中加入NaOH使pH=7,所得溶液中微粒浓度:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
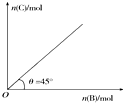 盛有足量A的体积固定的密闭容器中加入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H<0.一定条件下达到平衡时,C的物质的量与加入的B的物质的量的变化关系如图所示.下列说法不正确的是( )
盛有足量A的体积固定的密闭容器中加入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H<0.一定条件下达到平衡时,C的物质的量与加入的B的物质的量的变化关系如图所示.下列说法不正确的是( )| A. | 降低温度,则图中θ>45° | |
| B. | 平衡后再加入B,正反应速率增大,逆反应速率减小 | |
| C. | 平衡时B的转化率为50% | |
| D. | 平衡后再加入A,体系内气体密度不变 |
 Cu2O+H2↑
Cu2O+H2↑
 Al(OH)3+3H+,生成的胶体能吸附水中的悬浮物,从而达到净水目的.
Al(OH)3+3H+,生成的胶体能吸附水中的悬浮物,从而达到净水目的.