题目内容
 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:(1)④、⑤、⑥的原子半径由大到小的顺序是
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
(4)写出由②、③、④中的元素形成的等电子体分子
(5)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(6)由表中①、③、④三种元素形成盐的水溶液呈酸性,用离子方程式表示其原因:
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置,可知①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.
(1)同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大;
(2)元素的非金属性越强,对应的最高价含氧酸的酸性越强;
(3)①、④、⑤、⑧中的某些元素可形成NaOH、NaClO等离子化合物;
(4)原子总数相同、价电子总数也相同的微粒互为等电子体;
(5)两种元素的原子按1:1组成的常见液态化合物为H2O2;
(6)①、③、④三种元素形成盐的水溶液呈酸性,该盐为NH4NO3,铵根离子水解溶液呈酸性;
由表中①、②、③、④四种元素形成的一种盐的水溶液呈中性,该盐为醋酸铵.
(1)同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大;
(2)元素的非金属性越强,对应的最高价含氧酸的酸性越强;
(3)①、④、⑤、⑧中的某些元素可形成NaOH、NaClO等离子化合物;
(4)原子总数相同、价电子总数也相同的微粒互为等电子体;
(5)两种元素的原子按1:1组成的常见液态化合物为H2O2;
(6)①、③、④三种元素形成盐的水溶液呈酸性,该盐为NH4NO3,铵根离子水解溶液呈酸性;
由表中①、②、③、④四种元素形成的一种盐的水溶液呈中性,该盐为醋酸铵.
解答:
解:根据元素在周期表中的位置,可知①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.
(1)同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,则原子半径Na>Al>O,故答案为:Na>Al>O;
(2)②、③、⑦对应的元素分别为C、N、Si,同周期自左而右非金属性增强、同主族自上而下非金属性减弱,非金属性:N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则HNO3>H2CO3>H2SiO3 ,故答案为:HNO3>H2CO3>H2SiO3 ;
(3))①、④、⑤、⑧中的某些元素可形成NaOH、NaClO等离子化合物,电子式分别为 、
、 ,
,
故答案为: 或
或  ;
;
(4)原子总数相同、价电子总数也相同的微粒互为等电子体,由C、N、O中的元素形成的等电子体分子有:N2、CO(或N2O、CO2),故答案为:N2、CO(或N2O、CO2);
(5)表中两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,
故答案为:ab;
(6)①、③、④三种元素形成盐的水溶液呈酸性,该盐为NH4NO3,铵根离子水解:NH4++H2O?NH3?H2O+H+,破坏水的电离平衡,溶液呈酸性;
由表中①、②、③、④四种元素形成的一种盐的水溶液呈中性,该盐为CH3COONH4,
故答案为:NH4++H2O?NH3?H2O+H+;CH3COONH4.
(1)同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,则原子半径Na>Al>O,故答案为:Na>Al>O;
(2)②、③、⑦对应的元素分别为C、N、Si,同周期自左而右非金属性增强、同主族自上而下非金属性减弱,非金属性:N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则HNO3>H2CO3>H2SiO3 ,故答案为:HNO3>H2CO3>H2SiO3 ;
(3))①、④、⑤、⑧中的某些元素可形成NaOH、NaClO等离子化合物,电子式分别为
 、
、 ,
,故答案为:
 或
或  ;
;(4)原子总数相同、价电子总数也相同的微粒互为等电子体,由C、N、O中的元素形成的等电子体分子有:N2、CO(或N2O、CO2),故答案为:N2、CO(或N2O、CO2);
(5)表中两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,
故答案为:ab;
(6)①、③、④三种元素形成盐的水溶液呈酸性,该盐为NH4NO3,铵根离子水解:NH4++H2O?NH3?H2O+H+,破坏水的电离平衡,溶液呈酸性;
由表中①、②、③、④四种元素形成的一种盐的水溶液呈中性,该盐为CH3COONH4,
故答案为:NH4++H2O?NH3?H2O+H+;CH3COONH4.
点评:本题考查元素周期表与元素周期律的应用,难度不大,侧重于元素周期表和周期律的考查,注意整体把握元素周期表的价格,理解掌握元素周期律.

练习册系列答案
 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
标准状况下,向1L1.0mol/LNaOH溶液中通入17.92LCO2,充分反应后溶液中的CO32-,HCO3-的物质的量浓度之比为( )
| A、2:1 | B、1:2 |
| C、1:3 | D、1:4 |
有4种碳架如下的烃,下列表述正确的是( )


| A、a和d是同分异构体,且都可以发生取代反应 |
| B、b和c是同系物,且都只有一种一氯代物 |
| C、a和d都能发生加成反应,且在空气中燃烧都有黑烟 |
| D、c和d是同分异构体 |
分子式为C5H10O2的同分异构体甚多,其中符合下列条件的同分异构体共有(不考虑立体异构)①能发生银镜反应; ②能与金属钠或能发生水解反应( )
| A、12种 | B、13种 |
| C、16种 | D、18种 |
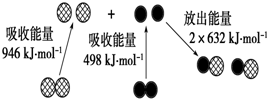 (1)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致.如图为N2(g)和O2(g)生成NO (g)过程中的能量变化:
(1)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致.如图为N2(g)和O2(g)生成NO (g)过程中的能量变化: