题目内容
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡.请根据所学的知识回答.下表是不同温度下水的离子积数据:
试回答下列问题:
(1)若25<t1<t2,则α 1×10-14(填“>”“<”或“=”)
(2)25℃下,某HCl溶液中c(HCl)=1×10-4 mol?L-1,则该溶液的pH= ,此时c(H+)H2O= mol/L,加水稀释1000倍,则稀释后溶液中pH _7(填“>”“<”或“=”)
(3)t2℃下,将pH=11的氢氧化钠钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2= .
(4)0.1mol/L NaHCO3溶液,请分析NaHCO3溶液显碱性的原因: .
(5)在NH4Cl溶液中,该盐水解的离子方程式为 .溶液中各种离子的浓度由大到小顺序为 .实验室中配制FeCl3溶液时常加入 溶液以抑制其水解; 把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 .
(6)已知AgCl在水中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq),在25℃时,氯化银的Ksp=1.8×10-10.现将足量氯化银放入100mL 0.2mol/L AgNO3溶液,氯离子的浓度为 mol/L.
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
(1)若25<t1<t2,则α
(2)25℃下,某HCl溶液中c(HCl)=1×10-4 mol?L-1,则该溶液的pH=
(3)t2℃下,将pH=11的氢氧化钠钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=
(4)0.1mol/L NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:
(5)在NH4Cl溶液中,该盐水解的离子方程式为
(6)已知AgCl在水中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq),在25℃时,氯化银的Ksp=1.8×10-10.现将足量氯化银放入100mL 0.2mol/L AgNO3溶液,氯离子的浓度为
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用,难溶电解质的溶解平衡及沉淀转化的本质,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:(1)水的电离是吸热反应,升高温度促进水电离,温度越高电离平衡常数越大;
(2)pH=-lg(H+),酸溶液中c(H+)H2O=c(OH-)=
,酸稀释接近中性时要考虑水的电离;
(3)t2℃下,将pH=11的氢氧化钠溶液中 c(OH-)=
mol/L=0.1mol/L,pH=1的硫酸溶液中c(H+)=0.1mol/L,pH=2的混合溶液中c(H+)=0.01mol/L,则混合溶液中c(H+)=
,据此计算V1:V2;
(4)碳酸氢钠溶液中,碳酸氢根离子水解程度大于电离程度导致其溶液呈碱性;
(5)氯化铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,结合电荷守恒判断离子浓度大小;
氯化铁为强酸弱碱盐,铁离子水解导致溶液呈酸性,为防止铁离子水解,应该加入少量酸,把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是氧化铁;
(6)c(Cl-)=
.
(2)pH=-lg(H+),酸溶液中c(H+)H2O=c(OH-)=
| Kw |
| C(H+) |
(3)t2℃下,将pH=11的氢氧化钠溶液中 c(OH-)=
| 10-12 |
| 10-11 |
| c(H+)V(H+)-c(OH-)V(OH-) |
| V(H+)+V(OH-) |
(4)碳酸氢钠溶液中,碳酸氢根离子水解程度大于电离程度导致其溶液呈碱性;
(5)氯化铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,结合电荷守恒判断离子浓度大小;
氯化铁为强酸弱碱盐,铁离子水解导致溶液呈酸性,为防止铁离子水解,应该加入少量酸,把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是氧化铁;
(6)c(Cl-)=
| Ksp |
| c(Ag+) |
解答:
解:(1)温度越高,水的电离程度越大,水的离子积越大,由于25<t1<t2,所以α>1×10-14,故答案为:>;
(2)pH=-lg(H+)=-lg10-4=4,酸溶液中c(H+)H2O=c(OH-)=
=
mol/L=10-10 mol/L,该溶液稀释1000倍时,溶液接近中性,则溶液的pH接近7,但小于7,
故答案为:4;10-10;<;
(3)t2℃下,将pH=11的氢氧化钠溶液中 c(OH-)=
mol/L=0.1mol/L,pH=1的硫酸溶液中c(H+)=0.1mol/L,pH=2的混合溶液中c(H+)=0.01mol/L,则混合溶液中c(H+)=
=
=0.01mol/L,V1:V2=9:11,故答案为:9:11;
(4)碳酸氢钠溶液中,碳酸氢根离子水解程度大于电离程度导致其溶液呈碱性,故答案为:HCO3-水解程度大于电离程度,溶液中c(OH-)>c(H+),溶液呈碱性;
(5)氯化铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,水解方程式为NH4++H2O?NH3.H2O+H+,结合电荷守恒知c(Cl-)>c(NH4+),铵根离子水解程度较小,则溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(OH-)>c(H+);
氯化铁为强酸弱碱盐,铁离子水解导致溶液呈酸性,为防止铁离子水解,应该加入少量稀盐酸,蒸干FeCl3溶液过程中氯化铁水解生成氢氧化铁和HCl,升高温度促进HCl挥发,所以蒸干氯化铁溶液得到氢氧化铁固体,灼烧氢氧化铁固体,氢氧化铁分解生成氧化铁和水,所以最后得到的主要固体产物是Fe2O3,
故答案为:NH4++H2O?NH3.H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);Fe2O3;
(6)c(Cl-)=
=
mol/L=9×10-10 mol/L,
故答案为:9×10-10.
(2)pH=-lg(H+)=-lg10-4=4,酸溶液中c(H+)H2O=c(OH-)=
| Kw |
| C(H+) |
| 10-14 |
| 10-4 |
故答案为:4;10-10;<;
(3)t2℃下,将pH=11的氢氧化钠溶液中 c(OH-)=
| 10-12 |
| 10-11 |
| c(H+)V(H+)-c(OH-)V(OH-) |
| V(H+)+V(OH-) |
| 0.1mol/L×(V2-V1) |
| V1+V2 |
(4)碳酸氢钠溶液中,碳酸氢根离子水解程度大于电离程度导致其溶液呈碱性,故答案为:HCO3-水解程度大于电离程度,溶液中c(OH-)>c(H+),溶液呈碱性;
(5)氯化铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,水解方程式为NH4++H2O?NH3.H2O+H+,结合电荷守恒知c(Cl-)>c(NH4+),铵根离子水解程度较小,则溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(OH-)>c(H+);
氯化铁为强酸弱碱盐,铁离子水解导致溶液呈酸性,为防止铁离子水解,应该加入少量稀盐酸,蒸干FeCl3溶液过程中氯化铁水解生成氢氧化铁和HCl,升高温度促进HCl挥发,所以蒸干氯化铁溶液得到氢氧化铁固体,灼烧氢氧化铁固体,氢氧化铁分解生成氧化铁和水,所以最后得到的主要固体产物是Fe2O3,
故答案为:NH4++H2O?NH3.H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);Fe2O3;
(6)c(Cl-)=
| Ksp |
| c(Ag+) |
| 1.8×10-10 |
| 0.2 |
故答案为:9×10-10.
点评:本题考查较综合,涉及盐类水解、难溶物的溶解平衡、弱电解质的电离、酸碱混合溶液定性判断等知识点,根据盐类水解特点、溶度积常数、弱电解质电离特点等知识点分析解答,注意(2)中酸无论如何稀释都不能变为中性或碱性溶液,只能是酸性溶液,接近中性,为易错点.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是( )
| A、将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,醋酸所加的水量少 |
| B、盐酸可与醋酸钠溶液反应生成醋酸 |
| C、相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等 |
| D、等体积、相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸pH变大 |
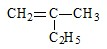
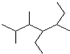 的名称
的名称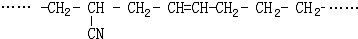 则合成它的单体是
则合成它的单体是 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: