题目内容
在VL硫酸铝溶液中,含有Wg Al3+离子,这种溶液中SO42-的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:根据n=
计算Al3+离子的物质的量,根据化学式可知SO42-离子的物质的量为Al3+离子的
倍,根据c=
计算SO42-浓度.
| m |
| M |
| 3 |
| 2 |
| n |
| V |
解答:
解:wg Al3+离子的物质的量为
=
mol,
根据Al2(SO4)3的化学式可知:n(SO42-)=
n(Al3+)=
×
mol=
mol,
则溶液中SO42-的物质的量浓度为c=
=
mol/L.
故选:B.
| wg |
| 27g/mol |
| w |
| 27 |
根据Al2(SO4)3的化学式可知:n(SO42-)=
| 3 |
| 2 |
| 3 |
| 2 |
| w |
| 27 |
| w |
| 18 |
则溶液中SO42-的物质的量浓度为c=
| ||
| VL |
| w |
| 18V |
故选:B.
点评:本题考查物质的量浓度的计算,难度不大,注意化学式的组成和有关物质的量的计算公式的运用.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
下列属于放热反应的是( )
| A、浓硫酸的稀释 |
| B、铝热反应 |
| C、氢气还原氧化铜 |
| D、Ba(OH)2?2H2O和NH4Cl(固体)混合 |
一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g),达到平衡后测得A气体的浓度为2.5mol/L,当恒温下将密闭容器的容积缩小到原体积
时,再达到平衡后,测得A浓度为4.5mol/L,则下列叙述正确的是( )
| 1 |
| 2 |
| A、平衡向逆反应方向移动 |
| B、x+y<z |
| C、C的体积分数提高 |
| D、B的转化率降低 |
下列有关仪器使用方法或实验操作正确的是( )
| A、分液时下层液体从分液漏斗下端放出,上层液体从上口倒出 |
| B、酸碱滴定实验中,酸式滴定管装液前不必先用待装溶液润洗 |
| C、蒸馏过程中,冷却水从冷凝管的上端通入 |
| D、配制一定物质的量浓度的溶液时,直接将称取的固体药品倒入容量瓶加水溶解 |
1molH2在O2中燃烧生成液态水放出285.8kJ的热量,则下列热化学方程式正确的是( )
| A、2H2(g)+O2(g)=2H2O(l)△H=+571.6kJ?mol-1 | ||
| B、2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ?mol-1 | ||
C、H2(g)+
| ||
D、H2(g)+
|
下列有关离子方程式的书写正确的是( )
| A、铝与氢氧化钠溶液反应:2Al+2OH-+H2O=2AlO2-+2H2↑ |
| B、氯化铁溶液与铁单质反应:Fe3++Fe=2Fe2+ |
| C、钠投入硫酸铜溶液中:2Na+Cu2+═2Na++Cu |
| D、碳酸氢钠溶液中加入烧碱溶液:HCO3-+OH-═CO32-+H2O |
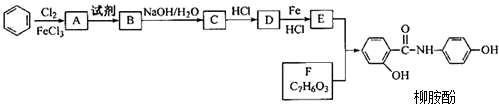
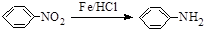 .请回答下列问题:
.请回答下列问题: 的化学方程式
的化学方程式