题目内容
写出下列物质在水中电离的方程式:
(1)H2S
(2)NH3.H2O
(3)NaHCO3 .
(1)H2S
(2)NH3.H2O
(3)NaHCO3
考点:电离方程式的书写
专题:
分析:(1)H2S是二元弱酸,属弱电解质,分两步电离;
(2)NH3?H2O为弱碱,部分电离出铵根离子和氢氧根离子;
(3)NaHCO3为强电解质,完全电离,碳酸氢根离子为弱酸酸根离子不能拆.
(2)NH3?H2O为弱碱,部分电离出铵根离子和氢氧根离子;
(3)NaHCO3为强电解质,完全电离,碳酸氢根离子为弱酸酸根离子不能拆.
解答:
解:(1)H2S是二元弱酸,应分步电离,H2S?H++HS-,HS-?H++S2-,
故答案为:H2S?H++HS-,HS-?H++S2-;
(2)NH3?H2O为弱电解质,部分电离用“?”,电离方程式为NH3?H2O?NH4++OH-,
故答案为:NH3?H2O?NH4++OH-;
(3)NaHCO3为强电解质,完全电离,电离方程式为:NaHCO3=Na++HCO3-;
故答案为:NaHCO3=Na++HCO3-.
故答案为:H2S?H++HS-,HS-?H++S2-;
(2)NH3?H2O为弱电解质,部分电离用“?”,电离方程式为NH3?H2O?NH4++OH-,
故答案为:NH3?H2O?NH4++OH-;
(3)NaHCO3为强电解质,完全电离,电离方程式为:NaHCO3=Na++HCO3-;
故答案为:NaHCO3=Na++HCO3-.
点评:本题考查电离方程式的书写知识,注意强电解质在溶液中能完全电离,弱电解质部分电离,离子团在电离方程式中不能拆开,强酸的酸式根离子要拆开,弱酸的酸式根离子不能拆开,(3)碳酸氢根离子为弱酸酸根离子不能拆,为该题易错点,题目难度不大.

练习册系列答案
相关题目
下到实验不能证明HR为弱酸的是( )
| A、室温下,NaR溶液的pH大于7 |
| B、加热NaR溶液时,溶液的pH变小 |
| C、将锌粒分别投入到1 mol?L-1的盐酸和HR中,HR产生氢气的速率慢 |
| D、室温下,0.1 mol?L-1HR的pH>1 |
对于2A2+3B2?C的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
| A、v(B2)=0.6mol/(L?s) |
| B、v(A2)=0.5mol/(L?s) |
| C、v(C)=0.45mol/(L?s) |
| D、v(B2)=2.4mol/(L?min). |
已知元素的原子序数,不可以推知原子的下列情况有( )
| A、中子数 |
| B、核电荷数 |
| C、核外电子数 |
| D、在周期表中的位置 |
下列离子方程式不正确的是( )
| A、将2mol/L NaAlO2溶液和3mol/L的HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ |
| B、向1mol/L明矾溶液50mL中滴入数滴0.1mol/L Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| C、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
| D、NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O |
 )是食品添加剂的增香原料,其合成路线如图:
)是食品添加剂的增香原料,其合成路线如图:


 ,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式
,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式


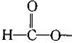


 和
和 ,
,