题目内容
3.写出下列物质的电离方程式:(1)K2SO4K2SO4=2K++SO42-
(2)NH4NO3NH4NO3=NH4++NO3-
(3)NaHSO4NaHSO4=Na++H++SO42-.
分析 (1)硫酸钾为强电解质,在溶液中完全电离出钾离子和硫酸根离子;
(2)硝酸铵为强电解质,在溶液中完全电离出铵根离子和硝酸根离子;
(3)硫酸氢钠在溶液中完全电离出钠离子、氢离子和硫酸根离子;
电离方程式中,强电解质用等号连接,弱电解质用可逆号连接,据此写出三者的电离方程式.
解答 解:(1)K2SO4为强电解质,在溶液中完全电离,其电离方程式为:K2SO4=2K++SO42-,
故答案为:K2SO4=2K++SO42-;
(2)NH4NO3为强电解质,在溶液中完全电离,其电离方程式为:NH4NO3=NH4++NO3-,
故答案为:NH4NO3=NH4++NO3-;
(3)NaHSO4为强电解质,在溶液中完全电离,其电离方程式为:NaHSO4=Na++H++SO42-,
故答案为:NaHSO4=Na++H++SO42-.
点评 本题考查了电离方程式的书写,题目难度中等,明确电解质的强弱及电离方程式的书写规则是解本题关键,注意原子团不能拆开,注意硫酸氢钠在熔融状态下电离方程式为NaHSO4═Na++HSO4-,为易错点,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
13.下列说法正确的是( )
| A. | 明矾具有杀菌消毒作用,可用于净水 | |
| B. | 烧碱不是碱、石炭酸不是酸、双氧水不是水 | |
| C. | 电解质在水溶液中的反应都是离子反应 | |
| D. | 我国首创的新型抗疟疾药青蒿素(C15H22O5)属于氧化物 |
14.在FeCl3和CuCl2混合液中,加入过量的铁粉,充分反应后,溶液中的金属离子是( )
| A. | Fe2+和 Fe3+ | B. | Fe2+ | C. | Cu2+ 和Fe2+ | D. | Cu2+ |
11.下列各组离子,能在溶液中大量共存的是( )
| A. | Ca2+Cl- CO32- | B. | Na+ Ba2+ Cl- | ||
| C. | Na+ SO42- Ba2+ | D. | H+ NO3- OH- |
18.下列物质的溶液中,加入淀粉溶液时,溶液颜色无变化;再滴加氯水,溶液会变蓝的是( )
| A. | NaCl | B. | NaBr | C. | KI | D. | I2 |
15.下列反应的离子方程式书写正确的是( )
| A. | 硅单质溶于入氢氧化钠溶液中:Si+2OH-+H2O═SiO3-+2H2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至沉淀物质的量最多:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 在碳酸氢镁溶液中加入过量氢氧化钠溶液:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | |
| D. | 向NaAlO2溶液中加入过量稀盐酸:AlO2-+4H+═Al3++2H2O |
12. HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:
HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:
(1)浓度不同HNO3氧化性不同,试举一例说明浓硝酸能与碳反应,而稀硝酸不能.
(2)HNO3能氧化多种金属.金属活动顺序中,Ag以前的金属都能与HNO3反应,但常温下Fe、Al(填元素符号)在浓HNO3中能钝化.
(3)盐酸对HNO3氧化性有影响.浓硝酸与浓盐酸按1:3体积比混合所得混合液称王水,具有强氧化性.金溶于王水产生遇空气变色的气体,金转化为易溶性强酸H[AuCl4].请写出其离子方程式:Au+4H++NO3-+4Cl-=NO↑+AuCl4-+2H2O.
(4)与金属反应的过程中,HNO3能被还原成多种含氮产物,如:NO2、HNO2、NO、N2O、N2、NH2OH、NH4+(或硝酸铵NH4NO3).
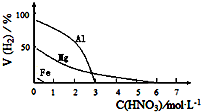
(5)HNO3是一种强酸,与活泼金属反应时,HNO3的还原产物中可能存在H2,某兴趣小组设计实验,探究金属与稀HNO3反应制取H2的影响因素,其结果如图所示.
该兴趣小组设计以下实验,探究金属与HNO3反应产生H2的影响因素可供选择的试剂:Fe粉、Mg粉,HNO3(0.1mol•L-1、2.0mol•L-1)
有同学认为,金属与HNO3反应是放热反应,温度也会影响金属与HNO3反应产生H2,反应器需要置于冷水浴中保持常温.
 HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:
HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:(1)浓度不同HNO3氧化性不同,试举一例说明浓硝酸能与碳反应,而稀硝酸不能.
(2)HNO3能氧化多种金属.金属活动顺序中,Ag以前的金属都能与HNO3反应,但常温下Fe、Al(填元素符号)在浓HNO3中能钝化.
(3)盐酸对HNO3氧化性有影响.浓硝酸与浓盐酸按1:3体积比混合所得混合液称王水,具有强氧化性.金溶于王水产生遇空气变色的气体,金转化为易溶性强酸H[AuCl4].请写出其离子方程式:Au+4H++NO3-+4Cl-=NO↑+AuCl4-+2H2O.
(4)与金属反应的过程中,HNO3能被还原成多种含氮产物,如:NO2、HNO2、NO、N2O、N2、NH2OH、NH4+(或硝酸铵NH4NO3).
(5)HNO3是一种强酸,与活泼金属反应时,HNO3的还原产物中可能存在H2,某兴趣小组设计实验,探究金属与稀HNO3反应制取H2的影响因素,其结果如图所示.
该兴趣小组设计以下实验,探究金属与HNO3反应产生H2的影响因素可供选择的试剂:Fe粉、Mg粉,HNO3(0.1mol•L-1、2.0mol•L-1)
| 影响因素 | 实验步骤 | 实验结论 |
| 金属的种类 | 两只烧瓶中各放入5g颗粒大小大致相同的Fe粉、Mg粉,分别加入2mol•L-1 HNO3溶液50mL,反应结束后,用气体分析仪测定气体中H2的体积分数 | 在该浓度的稀HNO3中,Mg能反应, Fe粉不反应, |
| 硝酸的浓度 | 两只烧瓶中各放入5g颗粒大小大致相同的Mg粉,分别加入0.1mol•L-1HNO3、2.0mol•L-1HNO3,反应结束后,用气体分析仪测定气体中H2的体积分数 | 硝酸浓度越稀,产生氢气越多. |
13.说法正确的是( )
| A. | 所有过渡元素都是金属元素 | |
| B. | CaO2和CaCl2含有的化学键类型完全相同 | |
| C. | 非金属原子之间不可能形成离子键 | |
| D. | 有化学键断裂的过程一定属于化学变化 |
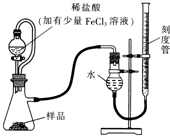 过氧化镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
过氧化镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量.