题目内容
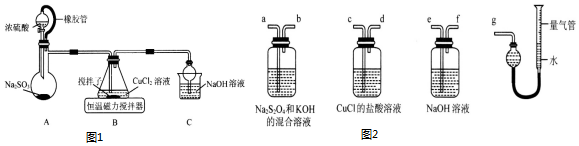
9.甲同学发现实验室中的小苏打固体样品中混有少量的氯化钠,故想测出其中的NaHCO3的质量分数,为此设计了四种实验方案方法一:(图1)
方法二:(图2)
方法三:(图3)

方法四:不使用化学试剂,使用实验室常用仪器.
按要求回答下列问题:
(1)方法一:加入足量的试剂ACa(OH)2或Ba(OH)2(填写A的化学式)可将HCO3-离子转化为沉淀并称重.;
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、胶头滴管外,还需要用到的是100mL容量瓶、玻璃棒,在操作2中应选择甲基橙作指示剂.
(3)在方法二中计算该样品中NaHCO3的质量分数为$\frac{42V(HCl)}{1000m}$×100%;
(4)在方法三中:根据所用的实验装置,除了装有药品的干燥管反应前后的质量外,还需测定的实验数据是所取固体样品质量;
(5)方法四的实验原理是:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑(用化学方程式表示).
分析 法一:(图甲)固态样品加试剂A使碳酸氢跟生成沉淀,再经过过滤、洗涤、干燥称量沉淀的质量,从而根据碳守恒计算碳酸氢钠的质量,进而计算质量分数;
方法二:(图乙)固态样品加水溶解成100ml溶液,取20ml加指示剂,用标准盐酸进行滴定,从而计算出碳酸氢钠的质量分数;
方法三:(图丙)固态样品加稀硫酸充分溶解,再经过浓硫酸干燥,用碱石灰吸收生成的二氧化碳气体,根据二氧化碳的质量计算碳酸氢钠的质量,进而计算质量分数;
方法四:不使用化学试剂,使用实验室常用仪器,应根据碳酸氢钠不稳定的性质,解热分解生成碳酸钠,根据质量的变化计算碳酸氢钠的质量,进而计算质量分数,以此解答该题.
解答 解:(1)与HCO3-反应产生沉淀的试剂有Ca(OH)2或 Ba(OH)2,所以试剂A为Ca(OH)2或 Ba(OH)2,
故答案为:Ca(OH)2或 Ba(OH)2;
(2)方法二中固态样品加水溶解成100ml溶液,所以还需100mL的容量瓶,并用玻璃棒溶解固体,引流溶液,故答案为:100 mL容量瓶、玻璃棒;
(3)由于盐酸与碳酸氢钠按1:1反应,所以消耗盐酸的物质的量即为碳酸氢钠的物质的量,又配100ml,取20ml进行滴定,所以原液是待测液的5倍,所以样品中NaHCO3的质量为V(HCl)×10-3×0.100×5×84=0.042V(HCl)g,质量分数为$\frac{42V(HCl)}{1000m}$×100%,故答案为:$\frac{42V(HCl)}{1000m}$×100%;
(4)方法三利用产生二氧化碳的质量来计算碳酸氢钠的质量分数,所用需要称量装有碱石灰的干燥管在实验前后的质量以及所取固体样品质量,
故答案为:所取固体样品质量;
(5)不用其他化学试剂,就只能是碳酸氢钠的受热分解了,利用固体反应前后的质量差,计算碳酸氢钠的质量分数,化学方程式是2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
点评 本题考查物质含量的测定,为高频考点,侧重考查学生的分析能力和实验能力,注意分析各种方法的原理,进而解答,题目难度中等.


| A. | 阳极的电极反应式:4OH--4e-═O2↑+2H2O | |
| B. | 若将阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,同样可制得纯净物的H3PO2 | |
| C. | H3PO2分子中P元素的化合价为+1价 | |
| D. | 阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2 |
| A. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆,原理相似 | |
| B. | “人造太阳”原理为:21H+31H→42He+10n,该过程不是化学变化 | |
| C. | “84”消毒液的有效成分是Ca(ClO)2 | |
| D. | 海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化 |

| A. | 曲线I代表HC2O4-的浓度随着pH增大先变小后变大 | |
| B. | 草酸的电离常数 Kal=l×10-1.3; Ka2=l×10-4.3 | |
| C. | pH=4时,c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| D. | $\frac{{c({C_2}{O_4}^{2-})•c({H_2}{C_2}{O_4})}}{{{c^2}(H{C_2}{O_4}^-)}}={10^{-3}}$ |
| A. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| B. | 标准状况下,22.4 L Cl2与水反应转移的电子数为NA | |
| C. | 50℃下,1L pH=2的稀硫酸溶液中含有的H+数目为0.01NA | |
| D. | 30 g乙酸和乙酸乙酯的混合物中含有的碳原子数目为NA |
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO.
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为
CO32->ClO->HCO3->CH3COO-.
(3)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:ClO-+H2O+CO2=HClO+HCO3-.
(4)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,填写下列表达式中的数据变化情况(填“变大”、“变小”或“不变”)
①$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$变大; ②$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变.
(5)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数,理由是当完全电离时应该是PH=4,现在PH值HX>CH3COOH,说明原来HX电离更多,故HX的电离平衡常数>醋酸的电离平衡常数.