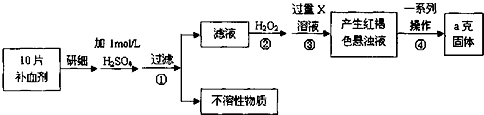
题目内容
A、B、C、D、E分别代表五种短周期元素,且原子序数依次增大.B的最外电子层是ns2npn+1.C的p亚层上未成对的电子比B少一个.D的二价阳离子与C的阴离子具有相同的电子层结构.E与D同周期且E在该周期中原子半径最小.B与A能生成具有刺激性气味的气体.
(1)B核外电子排布式为 .
(2)A与E化合时原子间以 键相结合,D与C化合时原子间以 键相结合.
(3)A、C直接形成的化合物与E的单质反应的离子方程式是 .
(4)B、D形成的化合物遇水时发生反应的化学方程式为 .
(1)B核外电子排布式为
(2)A与E化合时原子间以
(3)A、C直接形成的化合物与E的单质反应的离子方程式是
(4)B、D形成的化合物遇水时发生反应的化学方程式为
考点:位置结构性质的相互关系应用,化学键
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A、B、C、D、E分别代表五种短周期元素,且原子序数依次增大.B的最外电子层是ns2npn+1,若n=3,处于ⅥA族,E的原子序数大于20,不是短周期元素,不符合题意,故n=2,B的最外电子层为2s22p3,为氮元素;C的p能级上未成对的电子比B少一个,D的二价阳离子与C的阴离子是有相同的电子原结构,则离子有2个电子层,C处于第二周期,C的外围电子排布为2s22p4,为氧元素,D的质子数为10+2=12,为Mg元素;E与D同周期且在E在该周期中原子半径最小,则E为Cl元素;B与A能生成具有刺激性气味的气体,A的原子序数比B的小,则A为氢元素,生成的气体为氨气,据此解答.
解答:
解:A、B、C、D、E分别代表五种短周期元素,且原子序数依次增大.B的最外电子层是ns2npn+1,若n=3,处于ⅥA族,E的原子序数大于20,不是短周期元素,不符合题意,故n=2,B的最外电子层为2s22p3,为氮元素;C的p能级上未成对的电子比B少一个,D的二价阳离子与C的阴离子是有相同的电子原结构,则离子有2个电子层,C处于第二周期,C的外围电子排布为2s22p4,为氧元素,D的质子数为10+2=12,为Mg元素;E与D同周期且在E在该周期中原子半径最小,则E为Cl元素;B与A能生成具有刺激性气味的气体,A的原子序数比B的小,则A为氢元素,生成的气体为氨气,
(1)B为N,电子排布式为1s22s22p3,故答案为:1s22s22p3;
(2)A与E化合时生成HCl,原子间以共价键结合,D与C化合时生成氧化镁,原子间以离子键结合,故答案为:共价;离子;
(3)A、C直接形成的化合物为H2O,与氯气反应的离子方程式为:Cl2+H2O═H++Cl-+HClO,故答案为:Cl2+H2O═H++Cl-+HClO;
(4)B与D形成的化合物为Mg3N2,和水反应生成氢氧化镁和氨气,该反应的化学方程式:Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑,
故答案为:Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑.
(1)B为N,电子排布式为1s22s22p3,故答案为:1s22s22p3;
(2)A与E化合时生成HCl,原子间以共价键结合,D与C化合时生成氧化镁,原子间以离子键结合,故答案为:共价;离子;
(3)A、C直接形成的化合物为H2O,与氯气反应的离子方程式为:Cl2+H2O═H++Cl-+HClO,故答案为:Cl2+H2O═H++Cl-+HClO;
(4)B与D形成的化合物为Mg3N2,和水反应生成氢氧化镁和氨气,该反应的化学方程式:Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑,
故答案为:Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑.
点评:本题考查结构性质位置关系应用,涉及核外电子排布规律、常用化学用语、元素化合物性质等,推断元素是解题关键,难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
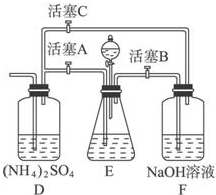 摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂.某研究性学习小组设计了下面的实验装置来制备摩尔盐.
摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂.某研究性学习小组设计了下面的实验装置来制备摩尔盐. 某同学设计实验探究构成原电池的条件,装置如下:
某同学设计实验探究构成原电池的条件,装置如下: