题目内容
燃煤烟气中含有大量的氮氧化合物(NOx)、二氧化硫和二氧化碳等,不宜直接排放到空气中,可采用以下措施对燃煤烟气进行处理.
(1)脱硝:选择性催化还原法的脱硝原理是在催化剂存在下,通入甲烷使氮氧化合物(NOx)转化为无害气体,发生如下反应:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为 .
(2)脱硫:①石灰石-石膏湿法烟气脱硫的工作原理是烟气中的二氧化硫与浆液中的碳酸钙以及鼓入的空气反应生成石膏(CaSO4?2H2O).某电厂用煤400吨(煤中含硫质量分数为2.5%),若燃烧时煤中的硫全部转化成二氧化硫,用石膏湿法烟气脱硫中有96%的硫转化为石膏,则可生产石膏 吨.
②新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由该铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中酸性氧化物分解除去,转化流程如图所示:
若2molZnFe2Ox与足量SO2可生成1.0molS,则x= .
(3)脱碳:从脱硝、脱硫后的烟气中获取二氧化碳,用二氧化碳合成甲醇是碳减排的新方向.将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H3
①取五份等体体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图1所示,则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”).
如增大压强,使反应达到平衡态,请在图2中画出因加压的反应速率随时间变化的关系图.

②在容积为1L的恒温密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图3所示.若在上述平衡体系中再充0.5mol CO2和1.5mol H2O(g) (保持温度不变),则此平衡将 移动(填“向正反应方向”、“不”或“逆反应方向”)

③甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.将CH4设计成燃料电池,其利用率更高,装置示意如图4(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.
a.0<V≤44.8L时,电池总反应方程式为 ;b.44.8L<V≤89.6L时,负极电极反应为 ;
c.V=67.2L时,溶液中离子浓度大小关系为 .
(4)甲醇燃料电池结构如图5所示.其工作时负极电极反应式可表示为 .若用此电池电解盛有100mL 3.00mol/L的CuSO4溶液(以石墨为电极),若两电极产生的气体体积恰好相等时(标准状况下),理论上消耗甲醇 g,此时溶液c(H+) .如果要使溶液复原需加入 (填物质名称) g.(假设反应前后体积不变)
(1)脱硝:选择性催化还原法的脱硝原理是在催化剂存在下,通入甲烷使氮氧化合物(NOx)转化为无害气体,发生如下反应:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为
(2)脱硫:①石灰石-石膏湿法烟气脱硫的工作原理是烟气中的二氧化硫与浆液中的碳酸钙以及鼓入的空气反应生成石膏(CaSO4?2H2O).某电厂用煤400吨(煤中含硫质量分数为2.5%),若燃烧时煤中的硫全部转化成二氧化硫,用石膏湿法烟气脱硫中有96%的硫转化为石膏,则可生产石膏
②新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由该铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中酸性氧化物分解除去,转化流程如图所示:

若2molZnFe2Ox与足量SO2可生成1.0molS,则x=
(3)脱碳:从脱硝、脱硫后的烟气中获取二氧化碳,用二氧化碳合成甲醇是碳减排的新方向.将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H3
①取五份等体体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图1所示,则上述CO2转化为甲醇反应的△H3
如增大压强,使反应达到平衡态,请在图2中画出因加压的反应速率随时间变化的关系图.

②在容积为1L的恒温密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图3所示.若在上述平衡体系中再充0.5mol CO2和1.5mol H2O(g) (保持温度不变),则此平衡将

③甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.将CH4设计成燃料电池,其利用率更高,装置示意如图4(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.
a.0<V≤44.8L时,电池总反应方程式为
c.V=67.2L时,溶液中离子浓度大小关系为
(4)甲醇燃料电池结构如图5所示.其工作时负极电极反应式可表示为
考点:化学平衡的计算,热化学方程式,原电池和电解池的工作原理,离子浓度大小的比较
专题:
分析:(1)根据盖斯定律可写出热化学方程式;
(2)①根据关系式S~SO2~CaSO4?2H2O来计算;
②依据氧化还原反应的电子守恒和化合物中的元素化合价代数为0计算得到;
(3)①由图可知,到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行;反应是气体体积减小的反应,增大压强,平衡正向进行,正逆反应速率都增大,正反应速率增大的大,据此画出变化曲线;
②依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算平衡常数,再充入物质,结合浓度商计算和平衡常数比较分析判断分析进行方向;
③n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应.
(4)图示分析判断,电解质溶液为酸性溶液,甲醇燃料在负极失电子发生氧化反应生成二氧化碳,结合电荷守恒书写电极反应.依据电极反应和电子守恒计算消耗甲醇质量,溶液中氢离子浓度计算注意消耗和生成的定量关系,电解过程中硫酸铜电解后继续电解水,结合电解铜离子物质的量和电解水的物质的量来计算恢复溶液浓度所需要的试剂.
(2)①根据关系式S~SO2~CaSO4?2H2O来计算;
②依据氧化还原反应的电子守恒和化合物中的元素化合价代数为0计算得到;
(3)①由图可知,到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行;反应是气体体积减小的反应,增大压强,平衡正向进行,正逆反应速率都增大,正反应速率增大的大,据此画出变化曲线;
②依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算平衡常数,再充入物质,结合浓度商计算和平衡常数比较分析判断分析进行方向;
③n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应.
(4)图示分析判断,电解质溶液为酸性溶液,甲醇燃料在负极失电子发生氧化反应生成二氧化碳,结合电荷守恒书写电极反应.依据电极反应和电子守恒计算消耗甲醇质量,溶液中氢离子浓度计算注意消耗和生成的定量关系,电解过程中硫酸铜电解后继续电解水,结合电解铜离子物质的量和电解水的物质的量来计算恢复溶液浓度所需要的试剂.
解答:
解:(1)将反应CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol和CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ/mol相加再约去公约数即可得反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),其反应热△H=
=-867kJ/mol,热反应方程式为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol;
(2)①S~SO2 ~CaSO4?2H2O
32 172
400t×2.5%×96% m
=
,
解得m=51.6t,
故答案为:51.6;
②新型纳米材料ZnFe2Ox可由化合物ZnFe2O4经高温还原制得,若2mol ZnFe2O x与SO2反应可生成1molS,则ZnFe2O x被还原为ZnFe2O4,令中铁元素的化合价为a,根据电子转移守恒,可知2mol×2×(3-a)=1mol×4,解得,a=2,利用化合价代数和为,2+2×2=2x,解得x=3,故答案为:3;
(3)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0,反应是气体体积减小的反应,增大压强,平衡正向进行,正逆反应速率都增大,正反应速率增大的大,据此画出变化曲线为: ,故答案为:<;
,故答案为:<; ;
;
②在容积为1L的恒温密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图1所示,平衡浓度c(CO2)=0.25mol/L,c(CH3OH)=0.75mol/L,则
CO2 (g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 0.75 0.75 0.75
平衡常数K=
=5.3
若在上述平衡体系中再充0.5mol CO2和1.5mol 水蒸气(保持温度不变),浓度商Q=
=5.3=K,则平衡不移动;
故答案为:不;
③n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;
a、当0<V≤44.8 L时,0<n(CH4)≤2mol,则0<n(CO2)≤2mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,
故答案为:CH4+2O2+2KOH=K2CO3+3H2O;
b、当44.8 L<V≤89.6 L,2mol<n(CH4)≤4mol,则2mol<n(CO2)≤4mol,发生反应①②③,得到K2CO3和KHCO3溶液,则负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-,
故答案为:CH4-8e-+9CO32-+3H2O=10 HCO3-;
c、当V=67.2 L时,n(CH4)=3mol,n(CO2)=3mol,则电池总反应式为3CH4+6O2+4KOH=K2CO3+2KHCO3+7H2O,则得到1molK2CO3和2molKHCO3的溶液,则c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(4)直接甲醇燃料电池结构如图2所示,图示分析判断,电解质溶液为酸性溶液,甲醇燃料在负极失电子发生氧化反应生成二氧化碳,结合电荷守恒书写负极电极反应为:CH3OH-6e-+H2O=6H++CO2;
解:(1)燃料电池中,通入燃料的电极是负极,通入氧气的电极是正极,所以N极是电解池的阳极,放电的是电解质中的氢氧根离子,即4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(2)乙池中M极是阴极,该极上析出金属铜,电极反应为:Cu2++2e-=Cu,当生成金属铜6.4g即0.1mol时,转移电子为0.2mol,甲池和乙池是串联电路,电路中转移电子的量相等,根据甲池中氧气的放电反应O2+2H2O+4e-=4OH-,当转移0.2mol电子时,消耗氧气的物质的量为0.05mol,体积是0.05mol×22.4L/mol=1.12L,故答案为:1.12;
(3)若用此电池电解盛有100mL 3.00mol/L的CuSO4溶液(以石墨为电极),若两电极产生的气体体积恰好相等时(标准状况下),理论上消耗甲醇,池中阳极反应是4OH--4e-=O2↑+2H2O,阴极反应依次是:Cu2++2e-=Cu,2H++2e-=H2↑,当铜离子全部放电时,转移电子是0.6mol,设转移nmol电子时,两极上产生气体的体积相等,则两极上产生气体的物质的量等式表示为:0.25n=0.5(n-0.6),解得n=1.2,根据反应CH3OH-6e-+H2O=6H++CO2,在转移6mol电子时,消耗CH3OH的量为1mol,当转移1.2mol电子时,理论上消耗甲醇0.2moL,质量是6.4g,此时溶液中氢离子浓度等于阳极增加的减去生成氢气减小的,浓度为=
=6mol/L,电解过程中电解硫酸铜后继续滴加水,消耗0.3mol铜离子,同时电解了0.6mol水,所以恢复溶液浓度需加入氢氧化铜,物质的量为0.3mol,质量=0.3mol×98g/mol=29.4g
故答案为:CH3OH-6e-+H2O=6H++CO2;6.4;6mol/L;氢氧化铜;29.4g.
| △H1+△H2 |
| 2 |
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol;
(2)①S~SO2 ~CaSO4?2H2O
32 172
400t×2.5%×96% m
| 32 |
| 400t×2.5% |
| 172 |
| m |
解得m=51.6t,
故答案为:51.6;
②新型纳米材料ZnFe2Ox可由化合物ZnFe2O4经高温还原制得,若2mol ZnFe2O x与SO2反应可生成1molS,则ZnFe2O x被还原为ZnFe2O4,令中铁元素的化合价为a,根据电子转移守恒,可知2mol×2×(3-a)=1mol×4,解得,a=2,利用化合价代数和为,2+2×2=2x,解得x=3,故答案为:3;
(3)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0,反应是气体体积减小的反应,增大压强,平衡正向进行,正逆反应速率都增大,正反应速率增大的大,据此画出变化曲线为:
 ,故答案为:<;
,故答案为:<; ;
;②在容积为1L的恒温密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图1所示,平衡浓度c(CO2)=0.25mol/L,c(CH3OH)=0.75mol/L,则
CO2 (g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 0.75 0.75 0.75
平衡常数K=
| 0.75×0.75 |
| 0.25×0.753 |
若在上述平衡体系中再充0.5mol CO2和1.5mol 水蒸气(保持温度不变),浓度商Q=
| 0.75×(0.75+1.5) |
| (0.25+0.25)×0.753 |
故答案为:不;
③n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;
a、当0<V≤44.8 L时,0<n(CH4)≤2mol,则0<n(CO2)≤2mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,
故答案为:CH4+2O2+2KOH=K2CO3+3H2O;
b、当44.8 L<V≤89.6 L,2mol<n(CH4)≤4mol,则2mol<n(CO2)≤4mol,发生反应①②③,得到K2CO3和KHCO3溶液,则负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-,
故答案为:CH4-8e-+9CO32-+3H2O=10 HCO3-;
c、当V=67.2 L时,n(CH4)=3mol,n(CO2)=3mol,则电池总反应式为3CH4+6O2+4KOH=K2CO3+2KHCO3+7H2O,则得到1molK2CO3和2molKHCO3的溶液,则c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(4)直接甲醇燃料电池结构如图2所示,图示分析判断,电解质溶液为酸性溶液,甲醇燃料在负极失电子发生氧化反应生成二氧化碳,结合电荷守恒书写负极电极反应为:CH3OH-6e-+H2O=6H++CO2;
解:(1)燃料电池中,通入燃料的电极是负极,通入氧气的电极是正极,所以N极是电解池的阳极,放电的是电解质中的氢氧根离子,即4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(2)乙池中M极是阴极,该极上析出金属铜,电极反应为:Cu2++2e-=Cu,当生成金属铜6.4g即0.1mol时,转移电子为0.2mol,甲池和乙池是串联电路,电路中转移电子的量相等,根据甲池中氧气的放电反应O2+2H2O+4e-=4OH-,当转移0.2mol电子时,消耗氧气的物质的量为0.05mol,体积是0.05mol×22.4L/mol=1.12L,故答案为:1.12;
(3)若用此电池电解盛有100mL 3.00mol/L的CuSO4溶液(以石墨为电极),若两电极产生的气体体积恰好相等时(标准状况下),理论上消耗甲醇,池中阳极反应是4OH--4e-=O2↑+2H2O,阴极反应依次是:Cu2++2e-=Cu,2H++2e-=H2↑,当铜离子全部放电时,转移电子是0.6mol,设转移nmol电子时,两极上产生气体的体积相等,则两极上产生气体的物质的量等式表示为:0.25n=0.5(n-0.6),解得n=1.2,根据反应CH3OH-6e-+H2O=6H++CO2,在转移6mol电子时,消耗CH3OH的量为1mol,当转移1.2mol电子时,理论上消耗甲醇0.2moL,质量是6.4g,此时溶液中氢离子浓度等于阳极增加的减去生成氢气减小的,浓度为=
| 1.2mol-0.6mol |
| 0.1L |
故答案为:CH3OH-6e-+H2O=6H++CO2;6.4;6mol/L;氢氧化铜;29.4g.
点评:本题主要考查了热化学方程式、转化率、化学平衡常数、化学平衡状态的判断、影响平衡移动的因素、原电池、电解池原理分析应用,考点较多,有一定的综合性,掌握基础是关键,中等难度.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
下列说法正确的是( )
| A、原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 |
| B、Fe3+的最外层电子排布式为3s23p63d5 |
C、基态铜原子的最外层的电子排布图: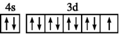 |
| D、所有非金属元素都分布在p区 |
 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )| A、⑥、⑧、⑨对应原子的半径依次减小 |
| B、②、⑦的最高价氧化物对应的水化物能相互反应 |
| C、元素⑩为Fe元素,处于常见周期表第四周期第VIIIB族 |
| D、①可分别与③、④、⑤均可形成既含极性键又含非极性键的化合物 |
 将氢氧化钠、氯化钡和硫酸铝三种固体组成的混合物溶于足量的水中,充分溶解,用1mol?L-1稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断正确的是( )
将氢氧化钠、氯化钡和硫酸铝三种固体组成的混合物溶于足量的水中,充分溶解,用1mol?L-1稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断正确的是( )| A、A点所表示的沉淀是:Al(OH)3、BaSO4 |
| B、B-C段所发生反应的离子方程式是:H++OH-→H2O |
| C、A-B段发生反应的离子方程式:Ba2++SO42-→BaSO4↓ |
| D、拐点E的横坐标为70mL |
已知2H2(g)+O2(g)→2H2O(g)+483.6kJ.下列说法或表达正确的是( )
| A、在相同的条件下,2mol 氢气与 1 mol 氧气的总能量小于2mol 水蒸气的总能量 | ||
B、H2(g)+
| ||
| C、氢气燃烧是放热反应,所以氢气和氧气反应不需要其他外界条件即可发生 | ||
| D、任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量 |
下列元素一定为主族元素的是( )
| A、其原子最外电子层只1个电子的元素 |
| B、最低负化合价为-3价的元素 |
| C、其原子最外层电子数大于电子层数的元素 |
| D、最高价氧化物对应的水化物是酸的元素 |
下列说法中,不正确的是( )
| A、CH4、NH3、H2O、三种分子的空间构型虽然不同,但中心原子的轨道杂化类型却相同 |
B、苯乙烯( )分子中的所有原子,不可能在同一平面内 )分子中的所有原子,不可能在同一平面内 |
| C、质谱仪可以测定有机化合物的相对分子质量 |
| D、红外光谱可以反映有机化合物中化学键或者官能团的相关信息 |