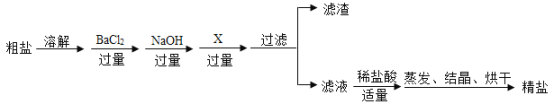
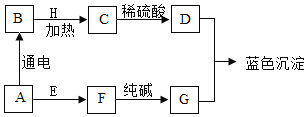
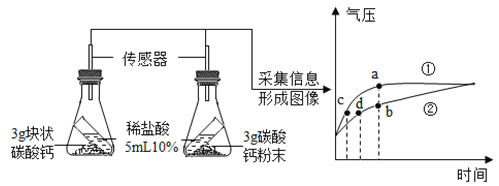
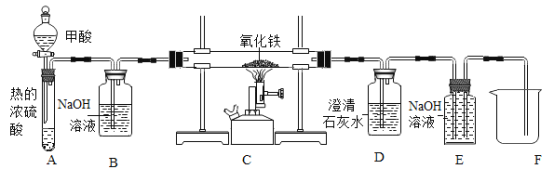
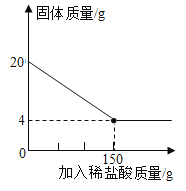
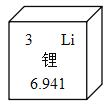
0 208456 208464 208470 208474 208480 208482 208486 208492 208494 208500 208506 208510 208512 208516 208522 208524 208530 208534 208536 208540 208542 208546 208548 208550 208551 208552 208554 208555 208556 208558 208560 208564 208566 208570 208572 208576 208582 208584 208590 208594 208596 208600 208606 208612 208614 208620 208624 208626 208632 208636 208642 208650 211419