题目内容
【题目】在研究酸和碱的化学性质时,某同学发现稀H2SO4与NaOH溶液混合后无明显现象产生,于是设计并完成了如下实验方案。
方案一:测定稀H2SO4与NaOH溶液混合前后的pH.
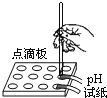
(1)用pH试纸测定NaOH溶液的pH,测得pH___________7 (选填“大于”、“等于”或“小于”);
(2)将定量的稀H2SO4加入该NaOH溶液中,混合均匀后测定其pH, pH=7。
方案二:向盛有NaOH溶液的烧杯中先滴加酚酞试液,后滴加稀硫酸,观察到溶液由红色变成无色。
结论:稀H2SO4与NaOH溶液发生了化学反应;
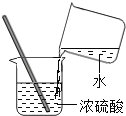
在上述实验中需要用到溶质质量分数为10%的稀硫酸,现用20g溶质质量分数为98%的浓硫酸进行稀释,则需要增加水的质量为________g, 若实验过程中量水时仰视读数,则会造成所得溶液溶质质量分数_____(选填“偏大”、“不变”或“偏小”)
(3)甲酸(HCOOH)是一种具有挥发性的酸, 甲酸在热的浓硫酸中会分解生成两种氧化物;CO和H2O。如图是制取CO,用CO还原氧化铁并检验气体产物,同时收集尾气中的CO的实验装置。
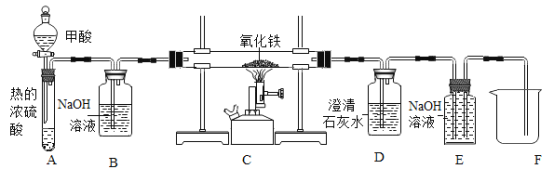
①写出E装置玻璃管内发生反应的化学方程式______。
②若没有B装置,则不能达到检验气体产物的目的,原因是_____。
③E装置可起到收集CO的作用,实验结束时,E中有部分溶液进入到F烧杯中,请设计实验证明该溶液溶质的成分中含有NaOH,写出实验步骤、现象和结论__。
(4)某特种钢村需要用富铁矿石(含铁量高于50%)来冶炼。研学实践小组为测出某地赤铁矿石(主要成分是Fe2O3)中的含铁量,进行实验:取20g赤铁矿石样品,逐渐加入稀盐酸,充分反应。实验相关数据如图所示(假设杂质不溶于水,也不与酸反应)。请计算:
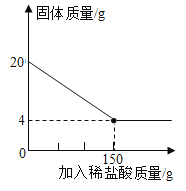
①20g赤铁矿石样品中氧化铁的质量_____。
②计算该样品中铁元素的质量分数,由此判断该赤铁矿石是否属于富铁矿石_____。
③实验中所用稀盐酸溶质的质量分数_____。
【答案】大于 176 偏小 2NaOH+CO2=Na2CO3+H2O 甲酸具有挥发性,若没有B装置,甲酸先和D装置中石灰水反应,D中石灰水可能不会变浑浊,无法检验C装置生成的二氧化碳 实验步骤:取适量F烧杯中液体于试管中,加入足量的氯化钙溶液;取上层清液加酚酞;实验现象:有白色沉淀产生;滴入酚酞的上层清液变红色;实验结论:说明原试管的溶液中含有氢氧化钠。 16g 样品中铁元素的质量分数为56%,属于富铁矿石。 14.6%
【解析】
(1)NaOH属于碱,其水溶液显碱性,所以其pH 大于7;故填:大于。
(2)在上述实验中需要用到溶质质量分数为10%的稀硫酸,现用20g溶质质量分数为98%的浓硫酸进行稀释,则需要增加水的质量为:20g×98%÷10%20g=176g;若实验过程中量水时仰视读数,导致量取水的体积偏大,则会造成所得溶液溶质质量分数偏小。故填:176;偏小。
(3)①E装置玻璃管内二氧化碳和氢氧化钠反应生成碳酸钠和水,发生反应的化学方程式:2NaOH+CO2=Na2CO3+H2O。故填:2NaOH+CO2=Na2CO3+H2O。
②B装置的作用是除去甲酸,因为甲酸是一种具有挥发性的酸,在反应过程中会挥发出来,若不除去会和后面D装置中石灰水反应,D中石灰水可能不会变浑浊,无法检验C装置生成的二氧化碳;故填:甲酸具有挥发性,若没有B装置,甲酸先和D装置中石灰水反应,D中石灰水可能不会变浑浊,无法检验C装置生成的二氧化碳。
③E中的氢氧化钠与C中反应生成的二氧化碳反应会生成碳酸钠,检验氢氧化钠一般利用它能使酚酞变红的性质,但是必须排除掉碳酸钠对它的干扰,因为碳酸钠也显碱性也能使酚酞变红,因此可以取适量F烧杯中液体于试管中,加入足量的氯化钙溶液;取上层清液加酚酞;实验现象:有白色沉淀产生;滴入酚酞的上层清液变红色;实验结论:说明原试管的溶液中含有氢氧化钠。故填:取适量F烧杯中液体于试管中,加入足量的氯化钙溶液;取上层清液加酚酞;实验现象:有白色沉淀产生;滴入酚酞的上层清液变红色;实验结论:说明原试管的溶液中含有氢氧化钠。
(4)①根据质量守恒定律可知:20g 赤铁矿石样品中氧化铁的质量:20g4g=16g,故填:16g。
②氧化铁中铁元素质量:![]() ,样品中铁元素的质量分数:
,样品中铁元素的质量分数:![]() ,由此判断该赤铁矿石属于富铁矿石。故填:样品中铁元素的质量分数为56%,属于富铁矿石。
,由此判断该赤铁矿石属于富铁矿石。故填:样品中铁元素的质量分数为56%,属于富铁矿石。
③设稀盐酸质量分数为x。
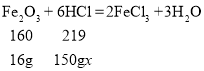
![]()
x=14.6%
答:实验中所用稀盐酸溶质的质量分数是14.6%。