题目内容
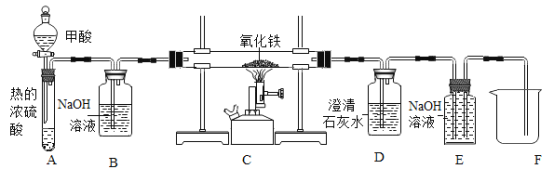
【题目】通过海水晒盐可得到粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如图。
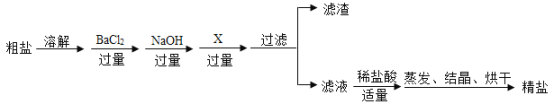
(1)加入过量试剂X的目的是_____。
(2)若在实验操作中,稀盐酸不小心稍加过量了,经分析可知也并不会对精盐有任何影响,原因是___。
【答案】除去溶液中的Ba2+和Ca2+ 盐酸具有挥发性,在蒸发的过程中会挥发掉,蒸发后,固体只剩余的是氯化钠
【解析】
根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答。
(1)氯化钡溶液能与硫酸钠溶液反应生成硫酸钡沉淀和氯化钠,氢氧化钠能与氯化镁溶液反应生成氢氧化镁沉淀和氯化钠;钙离子可用碳酸根离子沉淀,可以选用碳酸钠溶液,加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡,故X是碳酸钠溶液,加入过量试剂X的目的是除去溶液中的Ba2+和Ca2+。故填:除去溶液中的Ba2+和Ca2+。
(2)完全反应后,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子。若在实验操作中,稀盐酸不小心稍加过量了,经分析可知也并不会对精盐有任何影响,是因为盐酸具有挥发性,在蒸发的过程中会挥发掉。故填:盐酸具有挥发性,在蒸发的过程中会挥发掉,蒸发后,固体只剩余的是氯化钠。

 阅读快车系列答案
阅读快车系列答案【题目】同学们用碳酸钠溶液和盐酸的反应验证质量守恒定律,实验后他们对残留废液的成分进行探究。
[推理假设]
上述两种物质发生反应的化学方程式为_______,由此推测出废液中一定有NaCl,可能有_______。
[实验探究]
(1)确定废液中是否含有盐酸:
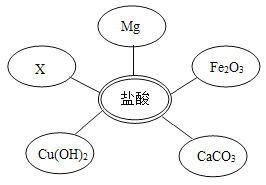
①选择试剂:根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质x是酸碱指示剂中的_____溶液。
②实验验证:某同学向废液中加入少量的铁粉,观察到_____, 确定废液中一定没有盐酸。
(2)确定废液中是否含有Na2CO3;某同学选用______测出废液的pH=10,确定废液中一定含有Na2CO3。
(3)处理废液,回收利用:欲从废液中得到纯净的NaCl,请完成如下实验方案设计。
方案 | 加入试剂 | 提纯的方法 | 方案评价 |
一 | 适量Ca(NO3)2溶液 | 过滤、 蒸发结晶 | ______(选填可行或不可行) |
二 | 稍过量的______ | ______ | 可行 |
(4)拓展运用:
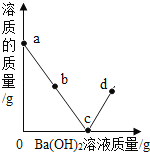
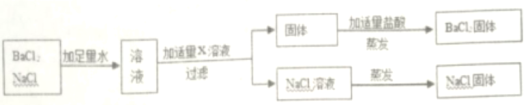
按如下图方案分离BaCl2和NaCl的固体混合物时,x溶液中溶质是_______。
【题目】利用如下图所示步骤进行实验,其中不能达到实验目的的是( )
实验目的 | 实验步骤 | |
A | 比较铁、铜的金属活动性强弱 | ①加入铜粉末;②加入适量稀硫酸搅拌;③加入铁片 |
B | 检验NaCl中混有Na2CO3 | ①加入少量样品;②加入适量水至全部溶解; ③加入适量稀盐酸 |
C | 验证KCl不能无限溶解 | 20°C时,①加入100g水;②加入18gKCl搅拌;③加入16gKCl搅拌(已知:20℃时,KCl的溶解度为34g) |
D | 配置50g溶质质量分数为5%的氯化钠溶液 | ①加入2.5gNaCl;②加入47.5g水;③搅拌至全部溶解 |
A.AB.BC.CD.D