题目内容
【题目】向一定质量的AgNO3溶液冲加入一定量铜和锌的混合粉末,充分反应后过滤,滤液呈蓝色。
(1)滤液中的溶质一定有____________(写化学式)。
(2)请写出造成滤液呈蓝色的化学方程式___________________。
(3)滤液质量一定比反应前AgNO3溶液质量小,其原因是___________________。
【答案】Zn (NO3)2、Cu (NO3)2 ![]() 锌和硝酸银反应生成硝酸锌和银,溶液质量变小;铜和硝酸银反应生成硝酸铜和银,溶液质量也变小
锌和硝酸银反应生成硝酸锌和银,溶液质量变小;铜和硝酸银反应生成硝酸铜和银,溶液质量也变小
【解析】
锌比铜活泼,铜比银活泼,向一定量AgNO3溶液中加入铜和锌的混合粉末时,锌先和硝酸银反应,如果硝酸银过量,则铜再和硝酸银反应。
(1)往AgNO3溶液中加入一定量锌和铜的混合粉末,锌先和硝酸银反应生成硝酸锌和银,锌完全反应后,铜再和硝酸银反应生成硝酸铜和银,充分反应后,过滤,滤液为蓝色,说明铜参加了反应,则滤液甲中一定含有Zn(NO3)2、Cu(NO3)2;故填:Zn(NO3)2、Cu(NO3)2。
(2)铜再和硝酸银反应生成硝酸铜和银造成滤液呈蓝色,反应的化学方程式为![]() ;故填:
;故填:![]() 。
。
(3)由化学方程式![]() 可知65份质量的锌和硝酸银反应生成硝酸锌和216份质量的银,溶液质量变小;
可知65份质量的锌和硝酸银反应生成硝酸锌和216份质量的银,溶液质量变小;![]() 64份质量的铜和硝酸银反应生成硝酸铜和216份质量的银,溶液质量变小,所以滤液质量一定比反应前AgNO3溶液质量小。故填:锌和硝酸银反应生成硝酸锌和银,溶液质量变小;铜和硝酸银反应生成硝酸铜和银,溶液质量也变小。
64份质量的铜和硝酸银反应生成硝酸铜和216份质量的银,溶液质量变小,所以滤液质量一定比反应前AgNO3溶液质量小。故填:锌和硝酸银反应生成硝酸锌和银,溶液质量变小;铜和硝酸银反应生成硝酸铜和银,溶液质量也变小。

 冲刺100分单元优化练考卷系列答案
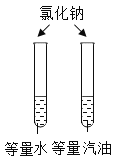
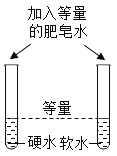
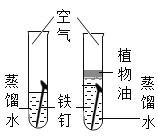
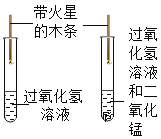
冲刺100分单元优化练考卷系列答案【题目】设计对比实验,控制变量是学习化学的重要方法,下列对比实验不能达到目的是( )
编号 | ① | ② | ③ | ④ |
实验设计 |
|
|
|
|
实验目的 | 探究同种物质在不同溶剂中的溶解性 | 区分硬水和软水 | 探究铁生锈的条件 | 研究二氧化锰的催化作用 |
A.①B.②C.③D.④
【题目】化学学科实践活动课上,老师拿来一包粉末。它是由长期放置在空气中的铁粉和久置的碱石灰干燥剂混合而成,让同学们设计实验进行探究。
(提出问题)固体样品的成分是什么?
(查阅资料)(1)碱石灰干燥剂是CaO和NaOH的混合物。
(2)BaCl2溶液显中性。
(猜想与假设)固体样品中可能含有 Fe、Fe2O3、CaO、NaOH、Ca(OH)2、Na2CO3和_____等七种物质。
(进行实验)
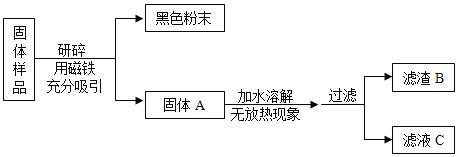
甲组同学对滤渣B的成分进行探究,记录如下:
实验操作 | 实验现象 | 实验结论及化学方程式 |
取少量滤渣B于试管中,加入足量稀盐酸,将生成的气体通入澄清的石灰水中 | ①_____________________ ②____________________ | 结论:滤渣B中的Fe2O3,CaCO3。盐酸和Fe2O3反应的化学方程式为:_________ |
乙组同学对滤液C的成分进行探究,记录如下:
实验操作 | 实验现象 | 实验结论 |
取少量滤液C于试管中,加入过量BaCl2溶液,静置,向上层清液中滴加无色酚酞试液,振荡 | 有白色沉淀生成 酚酞试液由无色变成红色 | 滤液C中有___________ |
(1)乙组同学实验中加入过量BaCl2 溶液的目的是_____。
(2)通过以上实验探究,该固体样品中能确定一定含有的成分是_____。
【题目】小雨阅读课外资料得知:双氧水分解除了用二氧化锰还可用氧化铜等物质作催化剂,于是他对氧化铜产生了探究兴趣.
(提出问题)氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
(设计实验)小雨以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略).
实验序号 |
| 其他物质质量 | 待测数据 |
① |
| / | |
② |
|
| |
③ |
|
|
(1)上述实验应测量的“待测数据”是________.
(2)若实验②比实验①的“待测数据”更________(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率.
(评价设计)你认为小雨设计实验③和实验②对比的目的是________.