【题目】在研究“酸碱中和反应”时,某兴趣小组同学想证明稀盐酸与氢氧化钠溶液混合后是否发生了化学反应,进行了如下探究:
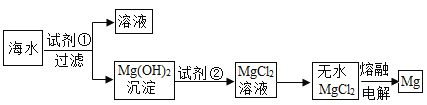
(1)在盛有氢氧化钠溶液的烧杯中滴人几滴酚酞试液,再逐滴加入稀盐酸,并不断搅拌(如图一)。用数字化传感器测得盐酸与氢氧化钠溶液混合前后的温度变化情况(如图二)。
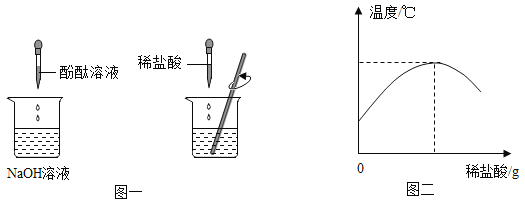
图一实验中滴加稀盐酸后发生的现象为__________________;由实验现象和曲线变化情况分析可知,盐酸和氢氧化钠溶液发生了反应并________(填“吸收”或“放出”)热量。
(2)从微观角度分析盐酸与氢氧化钠溶液的反应如图描述了该反应的微观实质,图中A、B、C处应填入的化学符号依次是____________。

(3)同学们讨论后认为,如果用检验盐酸和氢氧化钠减少(或消失)、或者有新物质生成,都能证明反应已经发生。继续探究实验后烧杯中溶质的成分,来证明反应的发生。
步骤 | 现象 | 结论 |
实验1:取烧杯中的溶液少许于试管中,加入硫酸铜溶液 | ____________________________ | 证明没有 |
实验2:另取烧杯中的溶液少许于试管中,加入硝酸银溶液 | 出现白色沉淀 | 证明含有 |
实验3:再取烧杯中的溶液少许于蒸发皿中,加热蒸干 | 有___________产生 | 证明有 |
(得出结论)氢氧化钠溶液和盐酸发生了中和反应。
(评价反思)有同学认为,仅通过实验2得出“溶液中含有![]() ”证据不足,理由是___________________。
”证据不足,理由是___________________。
【题目】氢氧化钠和氢氧化钙是两种常见的碱,化学实验活动课上,同学们进行了如图所示的实验。

(1)实验一中,B试管中发生反应的化学方程式为________________。A、B两支试管中共同的实验现象是___________________,其原因是_________________。
(2)实验二中,观察到C中有白色沉淀生成,该白色沉淀是___________(填化学式)。
①D试管中无现象,为了探究二氧化碳是否与氢氧化钠反应,甲同学又设计了如图所示的对比实验:

小洪同学认为该实验设计不符合对比实验的基本原则。理由是____________________。
②为了探究D中反应后的溶液中是否有碳酸钠,乙同学进行了如下探究:
方案 | 实验步骤 | 实验现象 | 结论、反应的化学方程式 |
一 | 取少量反应后溶液于一支试管中,加入过量的稀盐酸 | _______________________ | _________________________ |
二 | 取少量反应后溶液于另一支试管中,_________________ | ______________________ | 有碳酸钠生成:____________________ |
③丙同学设计下列实验来证明反应后的溶液中,除生成物碳酸钠还有剩余的氢氧化钠。
实验操作 | 实验现象 | 实验结论 |
取D中少量溶液于另一试管中,加入适量的 | 产生白色沉淀,酚酞试液变红 | 溶液中还有氢氧化钠存在 |
小军评价实验操作③的结论不正确,理由是___________________。
【题目】如图是两种固体的溶解度曲线。
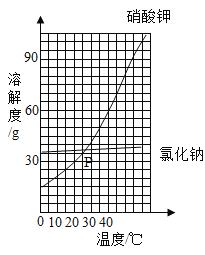
(1)40℃时,氯化钠的溶解度________(填“>”“=”或“<”)硝酸钾的溶解度;P点的含义是_________________。
(2)硝酸钾的溶解度随温度的升高而____________________。
(3)若将饱和的硝酸钾溶液从40℃降温到10℃_________(填“有”或“无”)晶体析出。
(4)20℃时,某实验小组取不同质量的硝酸钾,分别加入到100g水中,充分溶解后,所得溶液的质量与加入硝酸钾的质量对应关系如表:
实验一 | 实验二 | 实验三 | 实验四 | |
硝酸钾的质量/g | 20.0 | 25.0 | 30.0 | 35.0 |
所得溶液的质量/g | 120.0 | 125.0 | 130.0 | 131.6 |
根据上表数据,实验二所得的溶液为__________(填“饱和”或“不饱和”)溶液;20℃时,硝酸钾的溶解度为_________g。