题目内容
【题目】镁是一种用途很广的金属,目前世界上60%的镁是从海水(溶质主要含![]() 和
和![]() 等)中提取的,主要步骤如下:
等)中提取的,主要步骤如下:
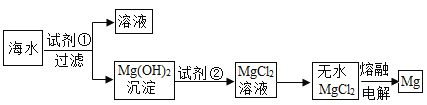
(1)工业生产中,加入试剂①应过量,原因是___________。发生反应的化学方程式为______________,试剂②的名称为__________________;
(2)写出无水![]() 在熔融状态下电解制取金属镁的化学方程式_________________,该反应属于基本反应类型中的__________________反应。
在熔融状态下电解制取金属镁的化学方程式_________________,该反应属于基本反应类型中的__________________反应。
(3)从海水中提取氯化镁时,经历了“氯化镁→氢氧化镁→氯化镁”的转化过程,这样做的目的是:____________________。
【答案】确保海水中的氯化镁完全反应 ![]() 稀盐酸
稀盐酸 ![]() 分解 富集提纯海水中的氯化镁
分解 富集提纯海水中的氯化镁
【解析】
((1)加入试剂①是要将海水中的氯化镁转化为氢氧化镁沉淀,故加入过量试剂①的原因是确保海水中的氯化镁完全反应,试剂①应属于碱,又能大量获取,故试剂①为氢氧化钙,氯化镁与氢氧化钙反应生成氢氧化镁沉淀和氯化钙,反应的化学方程式为:![]() ,由流程图可知,加入试剂②的目的是将氢氧化镁转化为氯化镁,故试剂②为稀盐酸;
,由流程图可知,加入试剂②的目的是将氢氧化镁转化为氯化镁,故试剂②为稀盐酸;
(2)无水![]() 在熔融状态下电解制取金属镁,同时生成氯气,反应的化学方程式为:
在熔融状态下电解制取金属镁,同时生成氯气,反应的化学方程式为:![]() ,该反应符合“一变多”特征,属于基本反应类型中的分解反应。
,该反应符合“一变多”特征,属于基本反应类型中的分解反应。
(3)从海水中提取氯化镁时,经历了“氯化镁→氢氧化镁→氯化镁”的转化过程,这样做的目的是:富集提纯海水中的氯化镁。

【题目】空气是人类最宝贵的自然资源。空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。图1是以空气和其他必要的原料合成氮肥(NH4HCO3)的流程。请按要求回答下列问题:
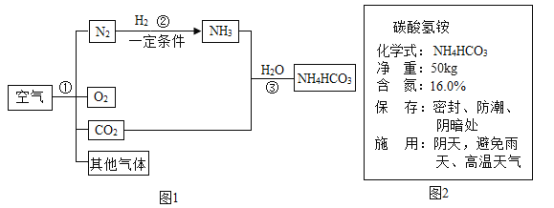
(1)步骤①中可利用氮气和氧气的_____不同分离出氮气和氧气,属于___变化。
(2)写出反应②的符号表达式:____________。
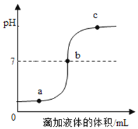
(3)图2是化肥碳酸氢铵包装袋上的部分说明:碳酸氢铵具有的性质是_________(填字母)。
A.易溶于水B.有挥发性 C.受热易分解
(4)这种化肥含氮量是否达到16%呢?带着这些问题,兴趣小组的同学取了一些化肥样品,进入实验室。
(查找资料)①碱石灰能够吸收H2O和CO2,但是不吸收NH3。
②浓硫酸能够吸收H2O和NH3,但是不吸收CO2。
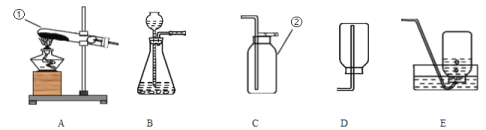
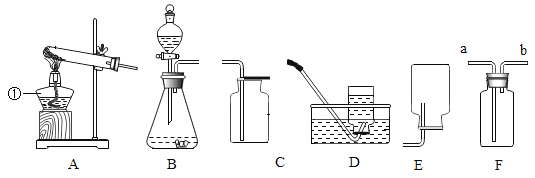
(性质探究)该同学设计了如下的实验装置:
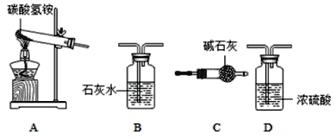
①用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是____________。
②取适量碳酸氢铵加入试管,连接A、B装置,加热,B中的现象是____________,B装置内发生反应的符号表达式为____________。
(含量分析)将装置A、C、D依次连接,加入20g化肥样品,加热至A中固体完全消失。
她称量装置D的质量如表:
实验前D装置的质量 | 149g |
实验后D装置的质量 | 152.4g |
③C装置的作用是__________。
④由表分析得知:反应中产生氨气的质量为_____g。
⑤通过反应的表达式可以知道:氨气中氮元素全部来自于碳酸氢铵(假设杂质中不含氮元素),请计算此化肥含氮元素的质量分数______________。(写计算过程)