【题目】某实验小组的同学将一定量的稀盐酸加入到盛有 NaOH 溶液的小烧杯中,进行“酸碱中和反应”的探究活动
Ⅰ.写出上述实验的化学方程式_____
Ⅱ.反应后溶液中溶质是什么呢? 有同学猜想如下:①NaCl ②NaCl、NaOH ③NaCl、HCl ④有NaCl、HCl和NaOH
以上猜想你认为不合理的是_____
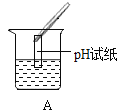
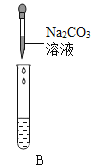
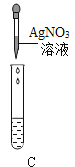
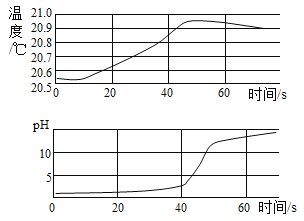
Ⅲ.为了验证上述合理的猜想,某同学取烧杯中的溶液少量于试管中,滴加几滴 CuSO4 溶液,无明显变化, 说明猜想_____不正确。另有同学利用烧杯中的溶液,并选用 pH 试纸、铜片、AgNO3 溶液、Na2CO3溶液,进行如下三个方案的探究
实验方案 | ①测溶液 pH | ②滴加 Na2CO3 溶液 | ③滴加 AgNO3 溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对比比色卡,pH<7 | 试管中有气泡 | 产生白色沉淀 |
实验结论 | 溶液中有HCl | 溶液中有HCl | 溶液中有HCl |
经过上述实验可确定猜想_____是正确的;实验方案中错误的是_____(填实验方案标号);操作有错误的实验是_____(填实验操作标号)
Ⅳ.若在烧杯中加入 20g40%的氢氧化钠溶液,再逐滴加入稀盐酸,当滴入的稀盐酸质量为 25g 时恰好完全反应
①所用氢氧化钠溶液中溶质的物质的量为_____mol
②加入盐酸的质量分数是多少_____?(根据化学方程式计算,精确到 0.1%)
【题目】溶液是我们生活中常见的物质,根据所学化学知识分析并回答问题:
Ⅰ.氯化钠、硝酸钾在不同温度时的溶解度如下表:
温度/℃ | 10 | 20 | 40 | 50 | |
溶解度/g | NaCl | 35.8 | 36.0 | 36.6 | 37.0 |
KNO3 | 20.9 | 31.6 | 63.9 | 85.5 |
从上表可知,两种物质的溶解度受温度变化影响较大的是_____;某温度下它们溶解度相同,则该温 度可能在_____范围内;50℃时,将氯化钠和硝酸钾各 50g 的混合物,加入到 100g 水中,充分搅拌,不能完全溶解的物质是_____,若再冷却到 10℃时,过滤后,所得溶液的质量是_____g
Ⅱ. 若要提纯混有少量氯化钠的硝酸钾饱和溶液,可采用方法是_____
Ⅲ.20℃时,能否配制出 30%硝酸钾溶液,理由是_____