题目内容
【题目】化学就在我们身边,与我们的生活、生产有着密切联系。请回答下列问题:
Ⅰ.利巴韦林(分子式:C8H12N4O8)是一种用于治疗病毒性肺炎与支气管炎的药物。该药物有______种元素组成,摩尔质量为_____;1mol 利巴韦林约含有_____个分子
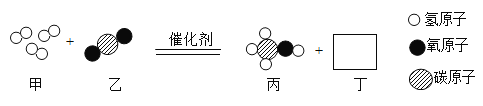
Ⅱ.有一种“酒精检测仪”中的反应原理为C2H5OH+4CrO3+6H2SO4→2Cr2(SO4)3+2CO2 +9X,反应中红色的CrO3转化为绿色的化合物,则CrO3 中Cr 的化合价为_____,X 的化学式为_____
Ⅲ. 用硫酸铜配制的农药波尔多液,可以防治葡萄生长中的病害。溶解硫酸铜时不宜用铁制容器,用化学方程式表示其原因_____
【答案】4 292 g/mo1 6.02×1023 +6 H2O ![]()
【解析】
(1)利巴韦林(分子式:C8H12N4O8)由碳、氢、氮、氧四种元素组成,相对分之质量为(12×8)+(1×12)+(14×4)+(16×8)=292,故摩尔质量为292 g/mo1;1mol 利巴韦林约含有1mol×6.02×1023/mol=6.02×1023个分子,故填:4;292 g/mo1;6.02×1023。
(2)C2H5OH+4CrO3+6H2SO4→2Cr2(SO4)3+2CO2 +9X,反应前有2C、18H、37O、4Cr,反应后有2C、28O、4Cr,根据质量守恒反应前后原子种类数目不变,故9X含有18H、9O,每个X含有2H、O,为H2O,设CrO3 中Cr 的化合价为x,根据化合价代数和为零x+(-2)×3=0,x=+6,故填: +6:H2O。
(3)硫酸铜和铁反应生成硫酸亚铁和铜,化学方程式为![]() 故溶解硫酸铜时不宜用铁制容器,故填:
故溶解硫酸铜时不宜用铁制容器,故填:![]() 。
。

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案【题目】某实验小组的同学将一定量的稀盐酸加入到盛有 NaOH 溶液的小烧杯中,进行“酸碱中和反应”的探究活动
Ⅰ.写出上述实验的化学方程式_____
Ⅱ.反应后溶液中溶质是什么呢? 有同学猜想如下:①NaCl ②NaCl、NaOH ③NaCl、HCl ④有NaCl、HCl和NaOH
以上猜想你认为不合理的是_____
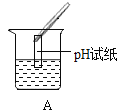
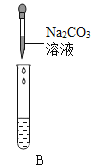
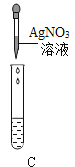
Ⅲ.为了验证上述合理的猜想,某同学取烧杯中的溶液少量于试管中,滴加几滴 CuSO4 溶液,无明显变化, 说明猜想_____不正确。另有同学利用烧杯中的溶液,并选用 pH 试纸、铜片、AgNO3 溶液、Na2CO3溶液,进行如下三个方案的探究
实验方案 | ①测溶液 pH | ②滴加 Na2CO3 溶液 | ③滴加 AgNO3 溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对比比色卡,pH<7 | 试管中有气泡 | 产生白色沉淀 |
实验结论 | 溶液中有HCl | 溶液中有HCl | 溶液中有HCl |
经过上述实验可确定猜想_____是正确的;实验方案中错误的是_____(填实验方案标号);操作有错误的实验是_____(填实验操作标号)
Ⅳ.若在烧杯中加入 20g40%的氢氧化钠溶液,再逐滴加入稀盐酸,当滴入的稀盐酸质量为 25g 时恰好完全反应
①所用氢氧化钠溶液中溶质的物质的量为_____mol
②加入盐酸的质量分数是多少_____?(根据化学方程式计算,精确到 0.1%)