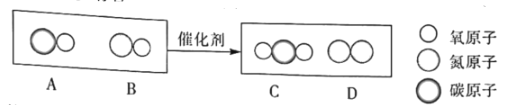
题目内容
【题目】阅读短文回答问题
人呼出的二氧化碳气体可以灭火,黄沙可以灭火,水也可以灭火。你知道吗?铜丝也能灭火!不信,请你试一试。用粗铜丝或多股铜丝绕成一个内径比蜡烛直径稍小点的线圈,圈与圈之间需有一定的空隙。点燃蜡烛,把铜丝制成的线圈从火焰上面罩下去,正好把蜡烛的火焰罩在铜丝里面,这时空气并没有被隔绝,可是蜡烛的火焰却熄灭了,这是为什么呢?原来铜不但具有很好的导电性,而且传递热量的本领也是顶呱呱的。当铜丝罩在燃着的蜡烛上时,火焰的热量大部分被铜丝带走,结果使蜡烛的温度大大降低,当温度低于蜡烛的着火点(190°C)时,蜡烛当然就不会燃烧了。
(1)铜丝是常见的金属材料,金属材料包括___________和__________。
(2)铜丝灭火利用了铜的___________性质。(填“物理”或“化学”)
(3)铜被灼烧后会生成黑色的氧化铜,利用一氧化碳可将其还原,化学方程式为:___________;铜在空气中长期放置会生成“铜绿”化学式为Cu2(OH)2CO3.这是铜与空气中的氧气、水、_____________ (填名称)共同作用的结果。
(4)某合金由两种金属组成,取30g该合金投入到足量的稀硫酸中,反应完全后,测得生成的氢气的质量为2g.则该合金的组成可能是______
A Zn和Fe BMg和Al CAl和Zn DMg和Cu
【答案】纯金属 合金 物理 ![]() 二氧化碳 CD
二氧化碳 CD
【解析】
(1)金属材料包括纯金属与合金;
(2)铜的导热性很强,将石蜡燃烧产生的热量迅速的散失,导致蜡烛的温度低于石蜡的着火点而熄灭,导热性属于物质的物理性质;
(3)在加热的条件下,一氧化碳与氧化铜反应生成铜和二氧化碳,反应的化学方程式为![]() ;铜在空气中长期放置会生成“铜绿”化学式为Cu2(OH)2CO3,由质量守恒定律可知:这是铜与空气中的氧气、水、二氧化碳共同作用的结果;
;铜在空气中长期放置会生成“铜绿”化学式为Cu2(OH)2CO3,由质量守恒定律可知:这是铜与空气中的氧气、水、二氧化碳共同作用的结果;
(4)假设合金为对应的化合物中为+2价的金属的纯净物。设金属为M,对应的相对原子质量为x,则
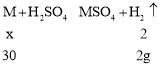
![]()
x=30
所以如果是两种金属都反应且都为+2价金属的情况下,则应该是相对原子质量一个大于30,一个小于30,则AB都不符。而铝折算为+2价时,对应的相对原子质量为18,而锌的相对原子质量为65,符合上面的分析,所以C正确。当金属一个反应一个不反应时,反应的金属的相对原子质量必须小于30,所以D正确。
故选:CD。

【题目】溶液是我们生活中常见的物质,根据所学化学知识分析并回答问题:
Ⅰ.氯化钠、硝酸钾在不同温度时的溶解度如下表:
温度/℃ | 10 | 20 | 40 | 50 | |
溶解度/g | NaCl | 35.8 | 36.0 | 36.6 | 37.0 |
KNO3 | 20.9 | 31.6 | 63.9 | 85.5 |
从上表可知,两种物质的溶解度受温度变化影响较大的是_____;某温度下它们溶解度相同,则该温 度可能在_____范围内;50℃时,将氯化钠和硝酸钾各 50g 的混合物,加入到 100g 水中,充分搅拌,不能完全溶解的物质是_____,若再冷却到 10℃时,过滤后,所得溶液的质量是_____g
Ⅱ. 若要提纯混有少量氯化钠的硝酸钾饱和溶液,可采用方法是_____
Ⅲ.20℃时,能否配制出 30%硝酸钾溶液,理由是_____
【题目】我国是以煤为主要燃料的大国,北京的雾霾天气与煤作为燃料有关。煤燃烧生成的SO2是酸雨的主要污染物。
(1)工业上常以生石灰(CaO)为脱硫剂,高温下与废气中的SO2、O2化合生成CaSO4,反应方程式为________________________。
(2)某同学利用中和反应的原理模拟脱硫,将SO2通入足量KOH溶液中,并探究反应后溶液中溶质的成分。
(资料)①亚硫酸盐能使酸性KMnO4溶液褪色;②常温下,硝酸能把亚硫酸及亚硫酸盐氧化成硫酸和硫酸盐;③亚硫酸与碳酸相似,在常温下易分解。
(猜想)(Ⅰ)K2SO3;(Ⅱ)K2SO4;(Ⅲ)________________。
(进行试验)
步骤 | 实验操作 | 实验现象 | 结论 |
① | 取一定量反应后的溶液于A、B两只试管中 | ||
② | 向A试管中滴入几滴酸性KMnO4溶液。 | ________。 | 证明有K2SO3。 |
③ | 向B试管中滴入足量的稀盐酸,再加入_______。 | 有白色沉淀生成 | 证明有________。 |
(作出判断)猜想________成立。
(拓展)实验③沉淀产生的反应方程式是________________________________________。
【题目】生石灰常用作食品干燥剂,干燥剂的包装袋上除了标明主要成分为生石灰外,还提醒人们注意:不可食用、不可浸水、不可开袋、不可玩耍、儿童勿取。
(1)同学们将一袋 干燥剂倒入一定 量的水中,发现生石灰开始“沸腾”,咕嘟咕嘟冒泡,不时有水蒸汽冒出,充分搅拌后过滤,得到白色沉淀和滤液。通过实验现象可知生石灰遇水会_____________(选填“吸热”或“放热”),写出有关反应的化学方程式:_________________。
(2)同学们想知道所得白色沉淀的成分,进行了如下探究:
[提出问题]白色沉淀中含有哪些物质?
[猜想假设]猜想1:只含有氢氧化钙;
猜想2:只含碳酸钙;
猜想3:_________________。
[实验探究]同学们进行了如下表所示的实验,请将下表填写完整;
实验步骤 | 现象现象 | 结论 |
I.取少量样品于试管中,加入足量的稀盐酸 | ______________ | 猜想1不成立 |
II.另取少量样品于试管中,加入适量水,充分搅拌后,滴加______________________ | 溶液呈红色 | 猜想3成立 |
[拓展延伸]①写出步骤I中发生反应的化学方程式:_________________。
②实验室正确保存生石灰的方法是_________________。