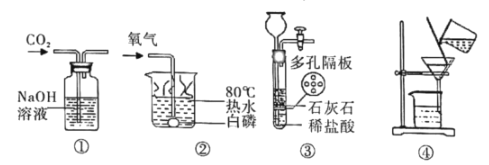
题目内容
【题目】利用废旧电池铜帽(含 Cu、Zn)提取 Cu,并得到 ZnSO4 溶液。主要流程如下图所示:
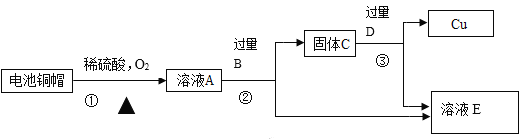
请回答下列问题:
Ⅰ.流程中②、③中的分离操作名称是_____
Ⅱ.步骤②中加入 B 物质为_____,过量的目的是_____
Ⅲ.溶液 E 中肯定有的溶质的化学式为_____
【答案】过滤 Zn 使硫酸铜完全转化为铜 ZnSO4和H2SO4
【解析】
利用废旧电池铜帽(含 Cu、Zn)提取 Cu,并得到 ZnSO4 溶液。反应最终得到的是铜和硫酸锌溶液,故E为硫酸锌,电池铜帽加入稀硫酸在氧气作用下,生成硫酸锌和硫酸铜,加入过量B硫酸铜被去除,又溶液中没有引入新的杂质,故B应该为锌,固体C为过量锌以及锌和硫酸铜生成的铜,故体C加入过量D生成硫酸锌,D应该为硫酸,又因为D过量滤液E中还含有硫酸。
(1)固液分离操作为过滤,故填:过滤。
(2)由分析可知B为锌,过量目的使硫酸铜完全转变为铜,故填:Zn;使硫酸铜完全转化为铜。
(3)由分析可知溶液E肯定含有溶质是ZnSO4和H2SO4,故填:ZnSO4和H2SO4。

【题目】为探究盐酸的化学性质,某化学小组做了如下实验:
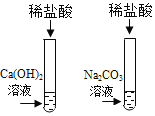
将反应后两只试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。
[提出问题]滤液中溶质的成分是什么?
[假设与猜想]猜想一: NaCl
猜想二: NaCl 和CaCl2
猜想三: NaCl、Ca(OH)2 和HCl
猜想四:___________。
[讨论与交流]经讨论同学们一致认为猜想_________是错误的。原因是____________(用化学方程式解释)
[实验与结论]
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量碳酸钠溶液 | 无现象 | 猜想四成立 |
取少量滤液于试管中,滴加适量_______________ | ______________________ |
[拓展与迁移]稀盐酸和稀硫酸有相似的化学性质,是因为它们的溶液中都存在_______________。