题目内容
【题目】某实验小组的同学将一定量的稀盐酸加入到盛有 NaOH 溶液的小烧杯中,进行“酸碱中和反应”的探究活动
Ⅰ.写出上述实验的化学方程式_____
Ⅱ.反应后溶液中溶质是什么呢? 有同学猜想如下:①NaCl ②NaCl、NaOH ③NaCl、HCl ④有NaCl、HCl和NaOH
以上猜想你认为不合理的是_____
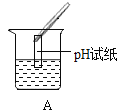
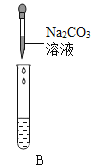
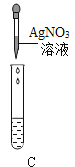
Ⅲ.为了验证上述合理的猜想,某同学取烧杯中的溶液少量于试管中,滴加几滴 CuSO4 溶液,无明显变化, 说明猜想_____不正确。另有同学利用烧杯中的溶液,并选用 pH 试纸、铜片、AgNO3 溶液、Na2CO3溶液,进行如下三个方案的探究
实验方案 | ①测溶液 pH | ②滴加 Na2CO3 溶液 | ③滴加 AgNO3 溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对比比色卡,pH<7 | 试管中有气泡 | 产生白色沉淀 |
实验结论 | 溶液中有HCl | 溶液中有HCl | 溶液中有HCl |
经过上述实验可确定猜想_____是正确的;实验方案中错误的是_____(填实验方案标号);操作有错误的实验是_____(填实验操作标号)
Ⅳ.若在烧杯中加入 20g40%的氢氧化钠溶液,再逐滴加入稀盐酸,当滴入的稀盐酸质量为 25g 时恰好完全反应
①所用氢氧化钠溶液中溶质的物质的量为_____mol
②加入盐酸的质量分数是多少_____?(根据化学方程式计算,精确到 0.1%)
【答案】![]() 猜想④ ② ③ ③ A 0.2 29.2%
猜想④ ② ③ ③ A 0.2 29.2%
【解析】
(1)稀盐酸和氢氧化钠反应生成氯化钠和水,化学方程式为![]() ,故填:
,故填:![]() 。
。
(2)猜想④不合理,因为盐酸和氢氧化钠发生反应,不能共存,故填:猜想④。
(3)滴加几滴 CuSO4 溶液,无明显变化,说明溶质不含氢氧化钠,猜想②错误,测溶液 pH<7,加碳酸钠生成气体都说明溶液中含有氯化氢,说明猜想③正确,实验方案中错误的是③,滤液中一定有氯化钠,无论是否有氯化氢滴加硝酸银都会生成白色沉淀,滴加硝酸银无法鉴别氯化氢,操作错误的是实验操作A,pH试纸不能直接放入待测液中,会污染待测液,故填:②;③; ③ ;A 。
(4)解:氢氧化钠质量为20g×40%=8g,氢氧化钠物质的量为;8g÷40g/mol=0.2mol
设盐酸中的溶质的物质的量是x。
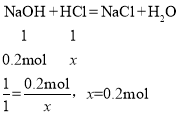
盐酸的溶质的质量分数=![]() ×100%=29.2%,故填:0.2;29.2%。
×100%=29.2%,故填:0.2;29.2%。

 新思维寒假作业系列答案
新思维寒假作业系列答案