【题目】化工生产中的废弃物再利用,可以有效节约资源、保护环境,下图是某化工厂利用废硫酸制备K2SO4的工艺流程图:

(1)生产上将CaCO3研成粉末的目的是______;
(2)写出反应![]() 的化学方程式______;
的化学方程式______;
(3)反应②充分反应后物质分离的方法是______;
(4)上述流程中,M溶液中溶质的主要成分是______(填写化学式);
(5)分析下表所示数据,则反应③在常温下可实现的原因是______;
物质 | KCl | K2SO4 | NH4Cl | (NH4)2SO4 |
溶解度/g(20℃) | 34.2 | 11.1 | 37.2 | 75.4 |
(6)洗涤反应③所得晶体最适宜的试剂是______(填序号);
AH2O B饱和K2SO4溶液 C 不饱和K2SO4溶液 D三者均可
(7)检验K2SO4晶体是否洗涤干净的方法是________________________________________。
(8)取50t质量分数为9.8%废硫酸用于该工艺制备K2SO4,理论可得到K2SO4质量为____t。
【题目】某同学进行如图两个实验。
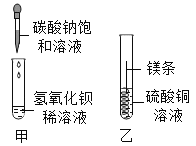
把甲、乙反应后的溶液倒入同一烧怀,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
(查阅资料)硫酸钡不溶于酸。
(提出猜想)白色沉淀为:Ⅰ._____;
Ⅱ.Mg(OH)2和BaSO4;
Ⅲ.Mg(OH)2和MgCO3.
(实验方案)
实验操作 | 实验现象与结论 |
过滤、洗涤白色沉淀备用;向白色沉淀中加入盐酸至过量 | ①若沉淀全部溶解,且无其它现象;猜想Ⅰ成立;其化学反应方程式为_____。 ②若_____且无气体产生,猜想Ⅱ成立。 ③若沉淀完全溶解,_____,猜想Ⅲ成立。 |
(拓展与思考)如果猜想Ⅲ成立,产生此结果的原因是做甲实验时_____;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是_____。