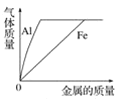
题目内容
【题目】某同学进行如图两个实验。
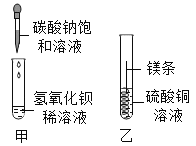
把甲、乙反应后的溶液倒入同一烧怀,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
(查阅资料)硫酸钡不溶于酸。
(提出猜想)白色沉淀为:Ⅰ._____;
Ⅱ.Mg(OH)2和BaSO4;
Ⅲ.Mg(OH)2和MgCO3.
(实验方案)
实验操作 | 实验现象与结论 |
过滤、洗涤白色沉淀备用;向白色沉淀中加入盐酸至过量 | ①若沉淀全部溶解,且无其它现象;猜想Ⅰ成立;其化学反应方程式为_____。 ②若_____且无气体产生,猜想Ⅱ成立。 ③若沉淀完全溶解,_____,猜想Ⅲ成立。 |
(拓展与思考)如果猜想Ⅲ成立,产生此结果的原因是做甲实验时_____;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是_____。
【答案】Mg(OH)2 Mg(OH)2+2HCl=MgCl2+2H2O 沉淀部分消失 产生气泡 碳酸钠过量 碳酸钠与氢氧化钡在同一溶液中是不能共存的
【解析】
{提出猜想}如果甲中的物质恰好完全反应,其中生成的氢氧化钠能与乙中反应生成的硫酸镁反应生成氢氧化镁沉淀,故填Mg(OH)2。
{实验方案}①猜想Ⅰ成立,则沉淀中只有氢氧化镁,氢氧化镁与稀盐酸反应生成氯化镁和水,故反应的化学方程式写为:Mg(OH)2+2HCl=MgCl2+2H2O。
②猜想Ⅱ成立,则白色沉淀为氢氧化镁和硫酸钡的混合物,加入稀盐酸后,氢氧化镁与稀盐酸反应生成氯化镁和水,硫酸钡与稀盐酸不反应且不溶于水,所以观察到的现象是沉淀部分消失,且无气体产生,故填沉淀部分消失。
③猜想Ⅲ成立,沉淀为氢氧化镁和碳酸镁的混合物,加入稀盐酸后,氢氧化镁与稀盐酸反应生成氯化镁和水,碳酸镁与稀盐酸反应生成氯化镁、水和二氧化碳,观察到的现象是沉淀完全溶解,产生气泡,故填产生气泡。
{拓展与思考}猜想III成立,则沉淀中的碳酸镁是由甲中的碳酸钠与乙中的硫酸镁反应生成的,说明甲实验中的碳酸钠是过量的,故填碳酸钠过量;
如果沉淀中有Mg(OH)2、MgCO3和BaSO4,则混合前甲中的溶液中应含有碳酸钠与氢氧化钡,而碳酸钠与氢氧化钡在同一溶液中是不能共存的,故填碳酸钠与氢氧化钡在同一溶液中是不能共存的。

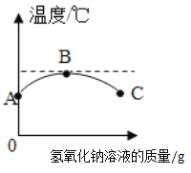
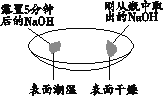
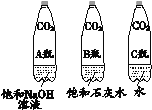
【题目】进行以下对比实验,研究NaOH的性质。
实验一 观察固体表面 | 实验二 向固体表面滴加稀盐酸 | 实验三 振荡3个塑料瓶 |
|
|
|
(1)实验一的结论是______。
(2)实验二的目的是______。
(3)实验三可证明CO2能与NaOH发生反应的实验现象是______,该反应的化学方程式为______。