【题目】化学科技小组同学将13.9g含杂质的纯碱样品(碳酸钠与氯化钠的混合物)
与90.5g稀盐酸相混合充分反应,测得反应生成气体的质量(m)与反应时间(t)的数据如下表所示:(已知:Na2CO3 +2HCl=2NaCl+CO2↑+H2O)
反应时间t/s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
气体质量m/g | 0 | 0.88 | 1.76 | 2.64 | 3.52 | 4.4 | 4.4 |
根据题目要求,回答下列问题:
(1)碳酸钠完全反应后,生成CO2的质量为_____g
(2)请根据表中数据在下面的坐标图中,画出反应是生成气体的质量(m)随时间(t)变化的曲线。____

(3)求纯碱样品中Na2CO3的质量_____。
(4)反应结束后,溶液中没有剩余固体,则完全反应后溶液中NaCl的质量分数为_____;若要将反应得到的溶液的浓度稀释为10%,则需加入_____g的蒸馏水。
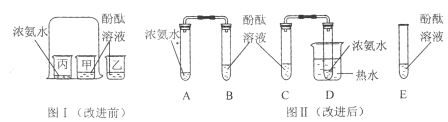
【题目】将“锡纸”剪成一段两头宽中间窄的纸条,然后两头分别连接电池的正负极,观察到“锡纸”立即燃烧。据此,小晟同学取某种“锡纸”进行了以下探究:
(1)“锡纸”燃烧的原因:“锡纸”两端接入电池两极后造成短路致使“锡纸”燃烧,从燃烧的条件开始“锡纸”不燃烧短路后却能燃烧的原因是_____。
(2)探究“锡纸”中金属的成分:“锡纸”中的金属是锡吗?
(查阅资料)①“锡纸”是锡箔或铝箔和纸粘合而成;②锌粉是一种深灰色固体;
③锡(Sn)与酸或盐溶液反应生成正二价的锡的化合物。
(提出猜想)猜想Ⅰ:“锡纸”中的金属是锡;猜想Ⅱ:“锡纸”中的金属是铝。
(进行实验)设计方案并进行实验
实验操作 | 实验现象 | 实验分析与结论 |
取打磨后的“锡纸”片放入试管中,滴加氯化锌溶液 | “锡纸”表面有深灰色固体析出 | 猜想_____(填“Ⅰ”或“Ⅱ”) 成立;反应的化学方程式为_____。 |
(交流讨论)①实验中打磨“锡纸”的目的是_____;
②下列物质的溶液可以替代氯化锌溶液完成上述实验的是_____(填序号)。
A 氯化铜 B 硝酸银 C 硫酸钠 D 硫酸亚铁
(拓展应用)如果电器着火下列采取的正确灭火方法是_____(填字母)。
A 立即用水扑灭 B 先切断电源,再用干粉灭火器灭火
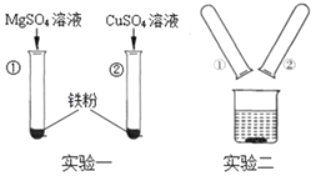
(3)小肖同学向MgSO4溶液、CuSO4溶液中分别加入铁粉(如图实验一),实验结束后,把①、②试管内的物质集中倒进一个烧杯中(如图实验二)。将实验二得到的物质进行过滤,向所得滤渣中加入稀盐酸,无气泡产生。则实验二得到的溶液中,溶质一定含有_____
(填化学式,下同),可能含有_____。
【题目】食品工业中合理使用食品添加剂可改善食品的色、香、味等品质.碳酸钠和碳酸氢钠就是食品中常用的添加剂,二者在不同温度时的溶解度如表所示
温度/℃ | 0 | 10 | 20 | 30 | 40 |
碳酸钠的溶解度/g | 7.1 | 12.5 | 21.5 | 39.7 | 49.0 |
碳酸氢钠的溶解度/g | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 |
(1)10℃时,碳酸钠的溶解度为_____.
(2)两种物质的溶解度曲线关系合理的是_____.

(3)区分两种物质的方法:取两种固体粉末各xg加入20℃的10g水中充分溶解,通过观察现象可区分碳酸钠和碳酸氢钠,x的值可能是___(填字母),此时碳酸氢钠溶液中溶质的质量分数是___(精确到0.01%)
A 2 B 0.96 C 0.5