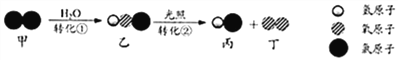
��Ŀ����
����Ŀ���ߴ������������ڵ��ӹ�ҵ��Ҫ��������ԭ�ϡ����������Һ�Ʊ��ߴ������ƵĹ����������£���֪����Ӧ���з�����Ӧ�Ļ�ѧ����ʽΪ��CO2+2NH3H2O+Ca(NO3)2�T2NH4NO3+X��+H2O(���������������ȫ��Ӧ)
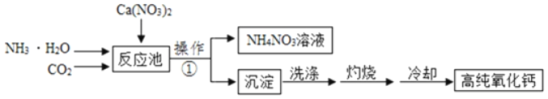
��ش��������⣺
(1)��������Ҫ�õ��IJ����������ձ���_____�������������в�������������_____��
(2)�ù��������п�ѭ��ʹ�õ�������_____��
(3)���չ����У������ķ�Ӧ�Ļ�ѧ����ʽΪ_____��
(4)��ȴ���ڸ���Ļ����н��У������Ƶõĸߴ��������л���е�������_____(�ѧʽ)��ԭ����_____(�û�ѧ����ʽ��ʾ)��
���𰸡�©�� ���� CO2 CaCO3![]() CaO+CO2�� Ca(OH)2 CaO+H2O��Ca(OH)2
CaO+CO2�� Ca(OH)2 CaO+H2O��Ca(OH)2
��������
(1)ͨ�����˿ɽ�������ˮ�Ĺ���������Һ����룬�ʲ������ǹ��ˣ�����ʱ��Ҫ�õ��IJ����������ձ���©���������������˲����в�������������������
(2)��Ϊ̼������ȷֽ������ɶ�����̼��������̼��ǰ�ߵķ�Ӧ���Ƿ�Ӧ����Ըù��������п�ѭ��ʹ�õ������Ƕ�����̼�����������̼��
(3)���չ����У���Ӧ����̼��ƣ��������������ƺͶ�����̼����Ӧ�����Ǹ��£���Ӧ�Ļ�ѧ����ʽΪCaCO3![]() CaO+CO2����
CaO+CO2����
(4)��ȴ���ڸ���Ļ����н��У������Ƶõĸߴ��������ܺ�ˮ��Ӧ�����������ơ������Ļ�ѧ����ʽΪCaO+H2O��Ca(OH)2��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�