11.下列物质的性质与所对应的用途没有直接关系的是( )
| A. | 氧气的密度比空气略大----用于急救病人 | |
| B. | 稀有气体的性质稳定----作保护气 | |
| C. | 煤气能燃烧---用于煮熟食物 | |
| D. | 干冰升华吸热----用于人工降雨 |
10.化学方程式错误的类型包括:A.物质化学式书写错误 B.未配平 C.遗漏反应条件 D.遗漏“↑”或“↓”.判断下列化学方程式的错误类型(填字母).
| 编号 | 化学方程式 | 错误类型 |
| ① | P+O2$\frac{\underline{\;点燃\;}}{\;}$P2O5 | |
| ② | CuCl2+2NaOH═Cu(OH)2+2NaCl | |
| ③ | H2O2$\frac{\underline{\;MnO_2\;}}{\;}$H2↑+O2↑ |
8.关于空气的说法,正确的是( )
| A. | 空气是一种氧化物 | B. | 洁净的空气是混合物 | ||
| C. | 洁净的空气是纯净物 | D. | 水中没有空气 |
6.守恒思想是以定量的角度观察化学世界的永恒主题.
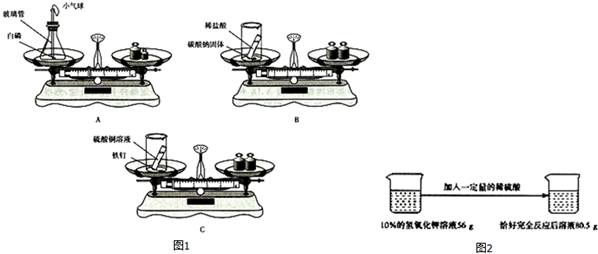
(1)用如图1所示的3个实验验证质量守恒定律,其中实验后天平不能保持平衡的是B(填序号),理由是装置未密闭,生成的二氧化碳气体逸出,导致左盘中容器内的物质总质量减少.
(2)卫星运载火箭的动力由高氯酸铵(NH4ClO4)发生反应提供,化学方程式为:
2NH4ClO4$\frac{\underline{\;高温\;}}{\;}$N2↑+C12↑+202↑+4X.则
①X的化学式为H2O.
②该反应属于基本反应类型中的分解反应.
(3)从微观角度分析有助于我们理解质量守恒定律.在一密闭容器内有四种物质A、B、C、D,它们在一定条件下发生化学反应.经过一段时间后停止反应,其中A、B、C、D的微观示意图和反应前后各物质的质量如下表所示.
①从微观角度分析,化学反应中质量守恒的原因是化学反应前后原子的种类不变,原子的数目不变,原子的质量不变.
②该反应中B和C的质量比为10:9.
③表中x的值是18.
(4)将0.8g草酸亚铁(FeC204)放在一个可称量的敞口容器中加热灼烧,固体质量随温度升高而变化的数据如下(下表中所注明的各温度下,容器中的固体均为纯净物):
①400℃时,容器中的固体为FeO(填化学式).
②400℃~500℃,发生了化合反应(填“分解反应”或“化合反应”).
③600℃~900℃,发生的反应可表示为6Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe3O4+O2↑.
(5)根据图2的信息计算:
①加人的稀硫酸质量为24.5g.
②所用稀硫酸溶质的质量分数为20%.(化学方程式:2K0H+H2S04=K2S04+2H20)

(1)用如图1所示的3个实验验证质量守恒定律,其中实验后天平不能保持平衡的是B(填序号),理由是装置未密闭,生成的二氧化碳气体逸出,导致左盘中容器内的物质总质量减少.
(2)卫星运载火箭的动力由高氯酸铵(NH4ClO4)发生反应提供,化学方程式为:
2NH4ClO4$\frac{\underline{\;高温\;}}{\;}$N2↑+C12↑+202↑+4X.则
①X的化学式为H2O.
②该反应属于基本反应类型中的分解反应.
(3)从微观角度分析有助于我们理解质量守恒定律.在一密闭容器内有四种物质A、B、C、D,它们在一定条件下发生化学反应.经过一段时间后停止反应,其中A、B、C、D的微观示意图和反应前后各物质的质量如下表所示.
| 物质 | A | B | C | D |  氮原子 氮原子 氧原子 氧原子 氢原子 氢原子 |
| 微观示意图 |  |  |  | 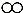 | |
| 反应前质量/g | 100 | 20 | X | y | |
| 反应后质量/g | 32 | 140 | 126 | 46 |
②该反应中B和C的质量比为10:9.
③表中x的值是18.
(4)将0.8g草酸亚铁(FeC204)放在一个可称量的敞口容器中加热灼烧,固体质量随温度升高而变化的数据如下(下表中所注明的各温度下,容器中的固体均为纯净物):
| 温度(℃) | 25 | 350 | 400 | 500 | 600 | 900 |
| 固体质量(g) | 0.80 | 0.80 | 0.40 | 0.44 | 0.44 | 0.43 |
②400℃~500℃,发生了化合反应(填“分解反应”或“化合反应”).
③600℃~900℃,发生的反应可表示为6Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe3O4+O2↑.
(5)根据图2的信息计算:
①加人的稀硫酸质量为24.5g.
②所用稀硫酸溶质的质量分数为20%.(化学方程式:2K0H+H2S04=K2S04+2H20)
4.某课外小组在研究金属与酸的化学反应时,设计了以下三个实验.

某课外小组在研究金属与酸的化学反应时,设计了以下三个实验:
【实验一】锰为不锈钢主要的添加元素.锰的氧化物是不锈钢的保护膜,可以提高不锈钢的耐腐蚀性.
(1)相同温度下,取大小相同、表面光亮的锰、镁、铜三种金属片,分别投人足量的、质量分数相同的稀盐酸中(反应中锰的化合价为+2价),现象如下:
上述三种金属的活动性由弱到强的顺序是铜锰镁;写出锰与稀盐酸反应的化学方程式:Mn+2HCl═MnCl2+H2↑.
(2)金属与酸的反应存在某种规律,请你分析下表中的数据,找到对应关系.
【实验二】应用:完成下列实验方案,(要求采用与实验一中不同的方法)
【实验三】根据不同种金属与同种酸能否反应以及反应的剧烈程度,可判断金属的活动性.也可根据同种金属与不同种酸反应的快慢,来判断不同种酸的酸性强弱.为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图1所示(夹持和固定装置已略去).在两试管中分别加人过量镁条,同时将相同浓度的稀盐酸和稀醋酸注人相应试管中,观察产生氢气的速率和体积.试回答下列问题:
(1)盐酸与镁反应的化学方程式为Mg+2HCl=MgCl2+H2↑,基本类型为置换反应.
(2)实验中收集到氢气的体积与时间的关系如图2所示.分析图中曲线变化规律,可得出盐酸酸性比醋酸强(填“强”或“弱”).
(3)实验中稀盐酸与镁条反应时,量筒中收集到氢气的体积比理论值高,可能的原因是①④.
①反应放热
②试管中有氢气残留
③实验装置气密性不好
④酸液进入试管,占据了一定的体积.
0 168457 168465 168471 168475 168481 168483 168487 168493 168495 168501 168507 168511 168513 168517 168523 168525 168531 168535 168537 168541 168543 168547 168549 168551 168552 168553 168555 168556 168557 168559 168561 168565 168567 168571 168573 168577 168583 168585 168591 168595 168597 168601 168607 168613 168615 168621 168625 168627 168633 168637 168643 168651 211419

某课外小组在研究金属与酸的化学反应时,设计了以下三个实验:
【实验一】锰为不锈钢主要的添加元素.锰的氧化物是不锈钢的保护膜,可以提高不锈钢的耐腐蚀性.
(1)相同温度下,取大小相同、表面光亮的锰、镁、铜三种金属片,分别投人足量的、质量分数相同的稀盐酸中(反应中锰的化合价为+2价),现象如下:
| 金属种类 | 锰(Mn) | 镁 | 铜 |
| 与盐酸反应 | 略慢 | 快 | 无明显现象 |
(2)金属与酸的反应存在某种规律,请你分析下表中的数据,找到对应关系.
| 等质量的金属(a克)与足量盐酸反应 | 镁 | 铁 | 锰 |
| 金属的相对原子质量 | 24 | 56 | 55 |
| 产生氢气的质量(g) | $\frac{a}{12}$ | $\frac{a}{28}$ | $\frac{a}{27.5}$ |
| 找到的规律 | 化合价相同的情况下,相对原子质量越大产生的氢气质量越小 (只描述规律,不写前提) | ||
| 实验目的 | 实验操作 | 实验现象和结论 |
| 探究Mn和Cu的金属活动性强弱 |
(1)盐酸与镁反应的化学方程式为Mg+2HCl=MgCl2+H2↑,基本类型为置换反应.
(2)实验中收集到氢气的体积与时间的关系如图2所示.分析图中曲线变化规律,可得出盐酸酸性比醋酸强(填“强”或“弱”).
(3)实验中稀盐酸与镁条反应时,量筒中收集到氢气的体积比理论值高,可能的原因是①④.
①反应放热
②试管中有氢气残留
③实验装置气密性不好
④酸液进入试管,占据了一定的体积.
 乙醇是一种环境友好的有机溶剂.
乙醇是一种环境友好的有机溶剂. 某化学兴趣小组对金属的性质做了如下探究,请你填写空格:
某化学兴趣小组对金属的性质做了如下探究,请你填写空格: 某化学学习小组为比较镁和铁的金属活动性强弱设计了如下实验方案.
某化学学习小组为比较镁和铁的金属活动性强弱设计了如下实验方案.