题目内容
5. 乙醇是一种环境友好的有机溶剂.
乙醇是一种环境友好的有机溶剂.(1)酒精检测仪中的反应原理为:C2H5OH+4X(橙红色)+6H2S04=2Cr2SO4)3(绿色)+2C02↑+9H2O,则物质X的化学式为CrO3.
(2)在催化剂作用下,乙醇与氧气、氢氧化钠在燃料电池中反应生成水和另一种常见的物质,同时产生电能,请你完成该反应的化学方程式:C2H50H+302+4Na0H$\frac{\underline{\;催化剂\;}}{\;}$Na2CO3+5H20
(3)现有一瓶无色、有特殊气味的液体,是甲醇(CH3OH)或乙醇(C2H5OH).通过测定该液体充分燃烧后生成的二氧化碳和水的质量可确定是哪种物质,解释原理.
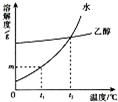
(4)固体物质W在水、乙醇两种溶剂中的溶解度随温度变化的曲线如图所示.下列说法错误的是d.
a.物质W能溶解在水和乙醇中
b.t1℃时,物质W在水中的溶解度为mg
c.t2℃时,物质W在水中与在乙醇中的溶解度相同
d.将t1℃时物质W的饱和水溶液升温至t2℃有晶体析出.
分析 (1)根据质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物X的化学式;
(2)根据化学反应前后各原子的种类及个数不变分析解决问题;
(3)根据质量守恒定律,化学反应前后元素的种类质量不变来解释即可;
(4)根据固体物质w在水、乙醇两种溶剂中的溶解度随温度变化的曲线图,可以判断物质w在水和乙醇中的溶解性;可以查出t1℃时,物质w在水中的溶解度;根据w的溶解度随温度变化的变化情况,可以确定升温后是否有溶质从溶液中结晶析出;可以比较同一物质在同一温度下、不同溶剂中的溶解度大小.
解答 解:(1)根据反应的化学方程式C2H5OH+4X(橙红色)+6H2SO4═2Cr2(SO4)3(绿色)+2CO2↑+9H2O,反应物中碳、氢、氧、硫原子个数分别为2、18、25、6,反应后的生成物中铬、碳、氢、氧、硫原子个数分别为4、2、18、37、6,根据反应前后原子种类、数目不变,则4X中含有4个铬原子和12个氧原子,则每个X分子由1个铬原子和3个氧原子构成,则物质X的化学式为CrO3;
(2)依据化学反应前后各原子的种类及个数不变可知:该物质中应该含有4个钠原子两个碳原子和6个氧原子,所以该物质是碳酸钠;
(3)反应后生成了二氧化碳和水,则根据质量守恒定律,化学反应前后元素的种类质量不变,则反应物中一定含有C、H元素;
已知生成的二氧化碳和水的质量,则根据二氧化碳和水的质量,利用某元素的质量=化合物的质量×该元素的质量分数可求出碳元素和氢元素的质量比;
再根据碳元素和氢元素的质量比即可求得碳元素与氢元素的原子个数比;最后与反应前甲醇和乙醇中的碳氢个数比对照,即可知道是哪种物;
(4)a、从该物质在水和乙醇中的溶解度曲线不难看出,该物质既能溶于水,也能溶于乙醇,故选项说法正确;
b、根据物质W在水中的溶解度曲线可知,在t1℃时,w在水的溶解度是mg,故选项说法正确;
c、由于在t2℃时,物质w在两种溶剂中的溶解度曲线交于一点,说明该物质在这两种溶剂中的溶解度相等,故选项说法正确;
d、由于物质w在水中的溶解度随温度的升高而增大,因此升温时它的饱和水溶液不会有晶体析出,反而会变成不饱和溶液,故选项说法错误.
故选:d.
故答案为:(1)CrO3;
(2)Na2CO3;
(3)反应后生成了二氧化碳和水,则根据质量守恒定律,化学反应前后元素的种类质量不变,则反应物中一定含有C、H元素;
已知生成的二氧化碳和水的质量,则根据二氧化碳和水的质量,利用某元素的质量=化合物的质量×该元素的质量分数可求出碳元素和氢元素的质量比;
再根据碳元素和氢元素的质量比即可求得碳元素与氢元素的原子个数比;最后与反应前甲醇和乙醇中的碳氢个数比对照,即可知道是哪种物;
(4)d.
点评 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是正确解题的关键.

 名校课堂系列答案
名校课堂系列答案| A. | 分子可分、原子不可分 | |
| B. | 分子和原子总在不断地运动 | |
| C. | 在原子中,电子数与中子数一定相等 | |
| D. | 分子可保持物质的化学性质,而原子不能 |
| 编号 | 化学方程式 | 错误类型 |
| ① | P+O2$\frac{\underline{\;点燃\;}}{\;}$P2O5 | |
| ② | CuCl2+2NaOH═Cu(OH)2+2NaCl | |
| ③ | H2O2$\frac{\underline{\;MnO_2\;}}{\;}$H2↑+O2↑ |
| A. | 矿泉水 | B. | 洁净的空气 | C. | 冰水混合物 | D. | 加碘食盐 |