题目内容
3. 某化学兴趣小组对金属的性质做了如下探究,请你填写空格:
某化学兴趣小组对金属的性质做了如下探究,请你填写空格:(1)若用铁丝、铜丝、银丝、稀硫酸和硫酸铜溶液,验证铁、铜、银的金属活动性顺序,实验结束后同学们欲对该实验的废液进行探究,他们先看到废液呈蓝色现象,认为废液中一定含有硫酸铜;还认为一定含有硫酸亚铁,依据是Fe+H2SO4 =FeSO4 +H2↑或Fe+CuSO4 =Cu+FeSO4(用化学方程式回答).若要将废液中的溶质全部转化为硫酸亚铁,应向废液中加人过量的铁粉,充分反应后过滤,滤渣中的物质为铁和铜,滤液中的溶质为硫酸亚铁.
(2)某同学向分别盛有等质量的铁粉和锌粒的试管中,倒入等质量、等溶质质量分数的稀硫酸,以“金属表面产生气泡的快慢”为标准来判断两种金属的活动性强弱.有的同学认为这种方案不够合理,理由是没控制相同的条件,颗粒大小不同.
(3)温度对金属与盐酸反应速率也有影响.实验表明,温度越高,盐酸与金属反应的速率越快.请你设计一个实验方案证明这一结论.你的方案是取两个烧杯,分别加入等质量的同种金属,再分别加入质量相等的足量的溶质质量分数相同的稀盐酸,对其中一个烧杯加热.可以观察到温度越高,盐酸与金属反应的速率越快.
(4)小组同学收集到含有硝酸银的溶液,他们利用铁和锌回收其中的金属银,其实验过程如图所示.下列说法正确的是BCD(填字母序号).
A.固体A中一定有银、铁,可能有锌
B.固体B一定是1.0g金属银
C.滤液C中的溶质可能只有硝酸锌
D.滤液C中的溶质可能是硝酸锌和硝酸亚铁.
分析 (1)硫酸铜溶液是蓝色的,铁能和硫酸铜反应生成硫酸亚铁和铜;
(2)金属的颗粒大小不同,与酸的反应速度也不同;
(3)要想证明温度对金属与盐酸反应速率也有影响就需要对实验中除温度以外的其它条件进行控制,创设相同的条件(温度不同),只有这样才能合理的得出结论;
(4)在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸反应生成氢气.
解答 解:(1)硫酸铜溶液是蓝色的,如果废液显蓝色,说明溶液中含有硫酸铜.故填:废液呈蓝色.
铁丝和稀硫酸反应生成硫酸亚铁和氢气,化学方程式为Fe+H2SO4 =FeSO4 +H2↑;铁丝和硫酸铜反应生成硫酸亚铁和铜,化学方程式为Fe+CuSO4 =Cu+FeSO4;故填:Fe+H2SO4 =FeSO4 +H2↑或Fe+CuSO4 =Cu+FeSO4;
如果向废液中加入过量的铁粉,可以把硫酸铜中的铜置换出来.故填:过量的铁粉.
充分反应后过滤,滤渣中的物质为铁和铜,滤液中的溶质为硫酸亚铁.故填:铁和铜;
(2)金属的颗粒大小不同,与酸的反应速度也不同,所以没控制相同的条件,颗粒大小不同,金属表面产生气泡的快慢,也会受到影响.
故答案为:没控制相同的条件,颗粒大小不同.
(3)要想证明温度对金属与盐酸反应速率也有影响,就需要对实验中除温度以外的其它条件进行控制,创设相同的条件(温度不同),可进行如下设计:取两个烧杯,分别加入等质量的同种金属,再分别加入质量相等的足量的溶质质量分数相同的稀盐酸,对其中一个烧杯加热.可以观察到温度越高,气泡生成的越快,即盐酸与金属反应的速率越快;故答案为:取两个烧杯,分别加入等质量的同种金属,再分别加入质量相等的足量的溶质质量分数相同的稀盐酸,对其中一个烧杯加热.可以观察到温度越高,盐酸与金属反应的速率越快.
(3)铁和锌在银的前面,铁能与硝酸银反应生成银和硝酸亚铁,锌能与硝酸银反应生成银和硝酸锌,锌能与硝酸亚铁反应生成铁和硝酸锌,得到的固体一定含有银,过滤后得到的固体能被磁铁吸引,则一定含有铁,剩余的固体B加入稀硫酸无变化,则不含有锌,
A、根据题意可知,固体A中一定含有铁和银,一定不含有锌,故A错误;
B、银不能被磁铁吸引,故固体B一定是1.0g金属银,故B正确;
C、若加入的锌适量,能将硝酸亚铁和硝酸银全部置换出来,则可能只含有硝酸锌,若加入的锌少量,铁大量,则溶质是硝酸锌和硝酸亚铁,故C正确;
D、若加入的锌少量,铁大量,则溶质是硝酸锌和硝酸亚铁,故D正确
故答案为:BCD.
点评 本题以实验探究的形式考查铁生锈的条件、实验中的条件控制、金属的活动性等,难度较大.

 名校课堂系列答案
名校课堂系列答案| A. | 石蜡熔化 | B. | 瓷碗破碎 | ||
| C. | 潮湿的衣服被晒干了 | D. | 洗净的铁锅出现锈渍 |
| A. | 检验溶液中的H+,加入AgNO3溶液,再加稀硝酸 | |
| B. | 检验溶液中的Cl-,先加硝酸钡溶液,再加AgNO3溶液 | |
| C. | 检验溶液中的SO42-,先加稀盐酸,再加BaCl2溶液 | |
| D. | 检验溶液中的SO42-,先加BaCl2溶液,再加稀盐酸 |
| A. | 碳原子核,含7个质子,8个中子 | B. | 氮原子核,含7个质子,7个中子 | ||
| C. | 碳原子核,含6个质子,7个中子 | D. | 氧原子核,含7个质子,8个中子 |
| A. | 空气是一种氧化物 | B. | 洁净的空气是混合物 | ||
| C. | 洁净的空气是纯净物 | D. | 水中没有空气 |
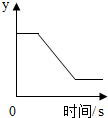 一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,如图所示,纵坐标(y)表示的是( )
一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,如图所示,纵坐标(y)表示的是( )| A. | 生成O2的质量 | B. | 固体中MnO2的质量 | ||
| C. | 固体中氧元素的质量 | D. | 固体中钾元素的质量分数 |
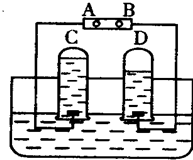 如图是电解水的简易装置.回答下列各问题:
如图是电解水的简易装置.回答下列各问题: